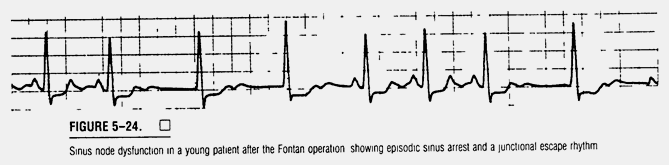
Рисунок 5-24. Дисфункция синусового узла у маленьких пациентов после операции Фонтена. Показаны эпизоды синусовой остановки и узловой эктопический ритм.
 |
Выбор генератора/электрода определяется размерами пациента и тяжестью сердечной патологии. Несмотря на техническую возможность имплантировать младенцам трансвенозный электрод для электрокардиостимуляции, вследствие маленького калибра сосудов система обычно ограничена однокамерным генератором. Кроме того, вследствие роста ребенка, могут понадобиться реоперации для выдвижения электрода. В большинстве центров наиболее часто применяемой техникой у младенцев остается эпикардиальная имплантация. Надо сказать, что эпикардиальные электроды обязательны у пациентов с интракардиальным шунтированием, имеющим риск системной эмболизации из образовавшегося на электроде тромба, и подвергнутых (или подвергаемых в будущем) операциям с кавопульмональными соединениями.
У младенцев со стабильной гемодинамикой обычно достаточно однокамерной желудочковой стимуляции. Когда ребенок подрастет, систему можно улучшить созданием двухкамерной стимуляции при плановой замене электрода. Если младенцы имеют плохую гемодинамику, приводящую к регургитации на атриовентрикулярных клапанах, или высокому конечно-диастолическому давлению, то независимо от возраста, следует рассмотреть вопрос о двухкамерной электрокардиостимуляции. Маленькие размеры и высокая надежность современных электрокардиостимуляторов резко сократили количество осложнений, возникающих при постоянной электрокардиостимуляции среди педиатрической популяции.
В этом разделе представлены основы фармакологии антиаритмиков у младенцев, существующие во внутривенной форме и применяемые для острой стабилизации периоперативных аритмий. Более полное обсуждение этих и других антиаритмических лекарств может быть найдено в отдельных детальных обзорах темы (24,28).
Несмотря на то, что у младших детей дигоксин долгое время был основным препаратом для лечения суправентрикулярной тахикардии, упор на него снизился, когда стали доступны более эффективные и быстродействующие препараты. Тем не менее, дигоксин остается удобной опцией для хронического контроля многих тахиаритмий. В случаях эктопической предсердной тахикардии, трепетания предсердий или мерцательной аритмии, дигоксин действует большей частью как препарат, контролирующий частоту сердечных сокращений, за счет угнетения быстрой проводимости в атриовентрикулярном узле. При скрытых добавочных путях и атриовентрикулярном узловом re-entry, дигоксин может напрямую препятствовать патологической циркуляции импульса. Из-за потенциального повышения антероградной проводимости по проводящим путям (30), дигоксина, вероятно, следует избегать при хроническом лечении синдрома Вольфа-Паркинсона-Уайта.
Дигоксин может назначаться внутривенно или per os. Биодоступность внутривенного дигоксина почти на 25% выше, чем оральной формы, поэтому при инъекционном введении дозы должны быть меньше. Дозирование дигоксина для лечения аритмий такое же, как и для лечения застойной недостаточности (то есть, дигитализация в течение 24 часов и последующее ежедневное поддержание) (32).
Аденозин является относительно новым и очень эффективным препаратом для лечения наиболее частых форм суправентрикулярной тахикардии (26). Эндогенные нуклеозиды обнаружены во всех тканях, однако, когда они инъецируются быстро болюсом, то могут вызывать глубокое замедление активности синусового и атриовентрикулярного узлов. Поэтому, тахикардии, которые включают атриовентрикулярный узел в состав своего re-entry контура, немедленно прекращаются, когда эффективная доза достигает сердца. Период полужизни этого препарата крайне короткий (10 секунд). Большая его часть метаболизируется клетками крови и эндотелия, когда он проходит по венозной системе. Поэтому, быстрое введение в вену должно производится в вену настолько близко к центральному кровообращению, насколько это возможно. У послеоперационных пациентов удобными путями введения являются центральная линия или предсердная мониторинговая линия. Первичная доза препарата, составляющая 0,1 мг на килограмм веса тела, вводится внутривенно быстро толчком, после чего линия промывается солевым раствором. Если эта доза не эффективна, может быть испробован второй болюс - 0,2 мг/кг.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.