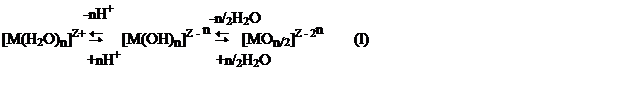 |
 Типичный пример первой стадии реакции (I) в щелочных средах - щелочной гидролиз аквакатиона [Al(H2O)6]3+:
Типичный пример первой стадии реакции (I) в щелочных средах - щелочной гидролиз аквакатиона [Al(H2O)6]3+:
[Al(H2O)6]3+ [Al(OH)(Н2О)5]2+ [Al(OH)2(Н2О)4]1+ [Al(OH)3(Н2О)3] (II)
с образованием аквагидроксокомплексов типа [М(OH)Y(H2O)n -Y]Z-Y или гидроксоком-плексов типа [М(OH)n]Z-n, эффективный заряд которых зависит от значений Z, nи Y. Такие моноядерные комплексы удобно рассматривать как первичные структурные группы, ПСГ,формирующейся в водном растворе системы. Далее ПГС могутконден-сироваться в биядерные и далее полиядерные вторичные структурные группы, ВСГ, с образованием связей через общий для пары комплексов лиганд, обычно ОН- или О2-.
Связующие ОН- лиганды для их отличия от терминальных ОН- групп гидроксидов называют ол-группами. Главная особенность ол-групп – в наличии бренстедовской кислотности, т.е. способности отщеплять протон (реакция оксоляции). Реакции образо-вания ол-групп и оксоляции можно выразить схемой:
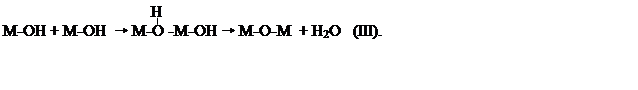 |
Оксоляция гидроксомплексов приводит к образованию акваоксокомплексов [МOK(H2O)n -K]Z - 2K, оксогидроксокомплексов [MOK(OH)n - K]Z - (K+N) или оксокомплексов [МOn]Z–2N. Очевидно, что оксокомплексы по химическому составу соответствуют оксидам. Типичный пример – реакция образования оксида кремния при кислотном гидролизе анионного оксогидроксокомплекса Si4+:
n[SiO2(OH)2]2- + 2n H+aq " n[SiO2(H2O)2] " (SiO2 )n+ 2nH2O. (IV)
Образующийся оксид SiO2 можно рассматривать как макромолекулу из nтетраэдров SiO4, связанных в вершинах общими атомами кислорода. Если стартовать от аквагидроксокомплекса кремния (IV), то эта реакция может быть записана как
n[Si(OH)Y(H2O)N -Y]4-Y + n(Y - 4) H+ aq " (SiO2 )n+ n(N - 2)H2O. (V)
Комплексы с гидроксо- или оксо- лигандами могут конденсироваться в би- и многоядерные ВСГ по схемам:
-МОН + -МОН " -М-(ОН)-М-ОН (VI)
[-M-O]- + -M-OH " [-M-O-M-OH]- (VII)
путем образования ол- или оксо-мостика между соседними ПСГ. В таких реакциях участвуют две незаряженные группы или же заряд несет только одна из групп; т.к. взаимодействие одноименных зарядов запрещено вследствие кулоновского оттал-кивания. Реакции типа (VI) и (VII) являются основой химической поликонденсации ПСГ в полиядерные ВСГ. Детальные особенности химизма этих реакций связаны с различными вариантами нуклеофильного замещения у катионов, могут включать образование промежуточных комплексов и т.д. (подробнее см., например, в [11]). Итог этих реакций - образование связей между соседними ПСГ через общие лиганды ОН- или О2-.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.