Z = +2: Be2+>Mg2+ > Ca2+ > Sr2+ > Ba2+, (XII-b)
причем ионы с большим значением заряда во всех случаях сильнее ионов с меньшим зарядом.
Эти ряды, обнаруженные Гофмейстером в 1888 [[70]] и расширенные с учетом более поздних данных, выражают относительную эффективность анионов и катионов во мно-гих явлениях физической химии и биохимии. Например, при эквимолекулярных кон-центрациях в такой последовательности изменяются значения поверхностного натяже-ния, вязкости и электролитической активности соответствующих растворов, эти ряды коррелируются с активностью при специфической адсорбции и ионном обмене, коагу-ляции золей и пептизации гелей, растворимости солей, проницаемости биологических мембран, значениями констант уравнения (4) и т.д. *[13]) [55-59,63-65]. Несмотря на более чем вековую историю, эти ряды остаются объектом внимания современных экспери-ментальных и теоретических исследований*[14], и продолжают использоваться в качестве критерия проверки развиваемых теорий [55-65]. Так, недавно последователь-ности (XI)-(XII) вновь подтверждены в экспериментальных исследованиях влияния ионов на формирование и свойства металлических наночастиц [[71]], на сборку мезопористых мезофаз, свойства мицеллярных систем и т.д. [58,[72],[73],[74],[75]].
Строгое количественное обоснование лиотропных рядов пока отсутствует [55-58, [76],[77]]. Однако в удовлетворительном качественном приближении они соответствуют наблюдаемому при перемещении по этим рядам слева направо снижению теплот гидра-тации, т.е. интенсивности взаимодействия ионов с водой. Этот эффект объясняют тем, что увеличение ионного радиуса Ri при Z = Const снижает плотность электростатичес-кого заряда на периферии иона se =Ze/4pRi2, где e – заряд электрона и, соответственно, ослабляет взаимодействие диполей воды с ионом. Одновременно рост Ri сопровожда-ется увеличением поляризуемости иона, которая определяет интенсивность в-д-в взаимодействий.
Ионы с большой плотностью электростатического заряда se удерживают гидрат-ную оболочку в виде кристаллогидратов даже после полного удаления свободной воды (например, Li+, Mg2+, Ca2+), а слабо связанная оболочка ионов с малыми значениями se может разрушаться уже растворе. Соотношение между кулоновским взаимодействием противоионов и прочностью их гидратных оболочек (т.е. величиной se) определяет условия образования электронейтральных ионных пар типа X+Y-, которые обнаружи-ваются при измерениях электропроводности концентрированных растворов или в их прецизионных структурных исследованиях. Такие пары состоят из противоионов, непосредственно соприкасающихся или разделенных одной-двумя молекулами воды, и окруженных общей гидратной оболочкой. Они – результат прорыва слабых оболочек между двумя хаотропами или прочных оболочек между двумя сильно взаимодейству-ющими космотропами (см. рис. 6). Пары космотроп + хаотроп обычно не образуются, т.к. в этом случае соотношение между интенсивностью взаимодействия и прочностью оболочек недостаточно для прорыва последних [55,[78],[79]]. Эта тенденция сохраняется и в условиях, когда один из ионов сорбирован. Если поверхность заряжена отрицательно, а ее заряд обусловлен анионами с малыми значениями se (т.е. большими Ri), то на этой поверхности предпочтительно сорбируются катионы с большими Ri (малыми se,) в последовательности, соответствующей лиотропным рядам. Но на поверхности, образо-ванной анионами с тем же зарядом, но с большими значениямиse (т.е. малыми Ri), предпочтительно адсорбируются катионы с малыми Ri (большими se), что объясняет наблюдаемое в этих ситуациях обращение лиотропных рядов. Та же схема рассуждений справедлива и для положительно заряженной поверхности и согласуется с экспери-ментом (см., например, [45,55,59,62,80]).
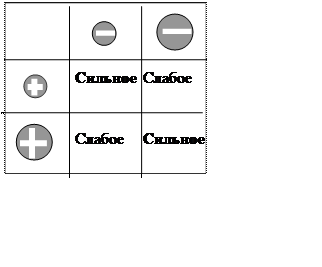 Рис. 6.
Интенсивность взаимодействия разных комбинаций ионов: знак(-) –
анионы, знак (+) –кати-оны, малые кружки – малые Ri (большие значения se,
космотропы), большие кружки - большие Ri (малые
значения se, хаотропы).
Рис. 6.
Интенсивность взаимодействия разных комбинаций ионов: знак(-) –
анионы, знак (+) –кати-оны, малые кружки – малые Ri (большие значения se,
космотропы), большие кружки - большие Ri (малые
значения se, хаотропы).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.