|
Ион |
Ri, нм |
Rhi, нм |
DН, кДж/моль |
Ион |
Ri, нм |
Rhi, нм |
DН, кДж/моль |
|
Н3О+ |
0.141 |
0.275 |
-1130 |
F- |
0.124 |
0.271 |
-505 |
|
Li+ |
0.069 |
0.208 |
-520 |
Cl- |
0.180 |
0.319 |
-363 |
|
Na+ |
0.102 |
0.244 |
-406 |
Br- |
0.198 |
0.352 |
-336 |
|
K+ |
0.138 |
0.305 |
-322 |
I- |
0.225 |
0.361 |
-295 |
|
Rb+ |
0.149 |
- |
-297 |
NO3- |
0.177 |
0.339 |
(-342)* |
|
Cs+ |
0.170 |
0.309 |
-276 |
ClO4- |
0.241 |
0.376 |
-238 |
|
NH4+ |
0.148 |
0.294 |
-330 |
SO42- |
0.242 |
0.382 |
(-1214)* |
|
Ag+ |
0.115 |
- |
-451 |
PO43- |
0.237 |
0.373 |
(-2806)* |
|
Mg2+ |
0.072 |
0.209 |
-1921 |
CH3COO- |
0.224 |
0.364 |
(-318)* |
|
Ca2+ |
0.100 |
0.243 |
-1577 |
Me4N+ |
0.280 |
- |
-230 |
|
Co2+ |
0.075 |
- |
-1996 |
Et4N+ |
0.337 |
- |
-186 |
|
Ni2+ |
0.069 |
- |
-2031 |
Pr4N+ |
0.379 |
- |
-210 |
|
Fe2+ |
0.078 |
- |
-1946 |
Bu4N+ |
0.413 |
- |
-(190-200)* |
|
Al3+ |
0.050 |
0.189 |
-4665 |
i-Pe3BuN+ |
0.436 |
- |
-(190-200)* |
|
Fe3+ |
0.065 |
- |
-4330 |
Ph4P+ |
0.424 |
- |
-(190-200)* |
*Оценка по формуле Борна DН =Z2/2ed Rhi, гдеed –диэлектрическая постоянная воды.
Радиусы Rhi для гидратированных катионов и анионов определяют по схеме, по-казанной на рис. 5, согласно которой анион может подойти к протону воды Н+ нес-колько ближе, чем катион к центру кислородного аниона. Поэтому при прочих равных условиях анионы могут взаимодействовать с водой сильнее, чем катионы того же раз-мера Ri. Это взаимодействие дополнительно усиливается из-за повышенной (по срав-нению с катионами) поляризуемости анионов, однако они по размерам, как правило, больше катионов.
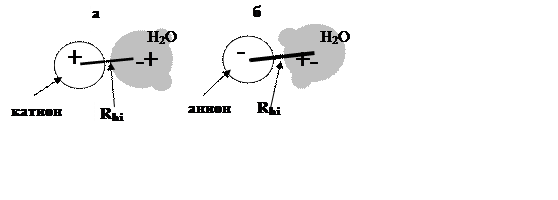 Рис.5.
Схема предполага-емого строения гидратирован-ных ионов, образующихся при
взаимодейсвии с водой катиона (а) и аниона (б).
Линиями выде-лены расстояния между центрами иона и молекулы воды,
соответствующие радиусам гидратированных ионов Rhi.
Рис.5.
Схема предполага-емого строения гидратирован-ных ионов, образующихся при
взаимодейсвии с водой катиона (а) и аниона (б).
Линиями выде-лены расстояния между центрами иона и молекулы воды,
соответствующие радиусам гидратированных ионов Rhi.
Из таблицы 2 следует, что снижение Ri при одинаковом заряде Z, как и увеличение Z при Ri » Const всех случаях приводит к росту DН, но разница DRi = Rhi - Ri мало зависит отRi, знака и величины Z. Среднее значение DR для всех приведенных в таблице ионов равно 0.142 нм, что близко радиусу молекулы Н2О. Некоторые откло-нения значений DRi от среднего (например, DRi = 0.164 нм для К+ или0.162 нм дляNO3-) можно объяснить, например, погрешностями измерений и усреднения их резуль-татов. Явная разница значений DRi для анионов и катионов в пределах точности приведенных оценок отсутствует, все ионы окружены оболочками толщиной в одну молекулу воды, основные различия – в энергии связи молекул воды с ионом.
Ввиду отсутствия строгой теории для качественного сопоставления эффектив-ности ионов с одинаковыми зарядами, используем так называемые лиотропные серии (или ряды Гофмейстера), которые можно представить в виде:
для анионов
Z = -1: F- > HCOO- > CH3COO- > Cl- > Br-,> NO3- > I- > ClO4-> SCN- (XI-a)
Z = -2: SO42- > HPO42- > CrO42-; (XI-b)
для катионов
Z = +1: Н+ >Li+ > Na+> K+> Rb+> Cs+> NH4+> (CH3)4N +; (XII-a)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.