Введение в систему ионов, инородных частиц или аполярных включений сущест-венно влияет на это тонкое равновесие. Начнем с неполярных “гостей“ типа инертных газов, СН4, других углеводородов, фторуглеродов и т.д., которые способны действовать с водой только за счет в-д-в сил. Их внедрение способно разрывать решетку Н-связей в объемной воде, но при достаточно малом, нано- или субнанометровом размере гостя решетка Н-связей сохраняется путем образования так называемых структур внедрения - клатратов (рис.4). В таких структурах гость размещается в ячейках, стенки которых построены из 4-координированных молекул воды (каждая молекула связана с тремя соседними, расположенными на вершинах ячейки-многогранника, четвертой является Н-связь с “внешней“ молекулой Н2О). Стабильность таких структур определяется допустимыми углами между Н-связями.
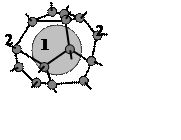 Рис.4.
Клатратная (гидратная) ячейка, формируемая молекулами воды вокруг неполярной
молекулы 1; 2 – четырех-координированная молекула Н2О.
Рис.4.
Клатратная (гидратная) ячейка, формируемая молекулами воды вокруг неполярной
молекулы 1; 2 – четырех-координированная молекула Н2О.
Такие клатратные структуры образуют газогидраты [[66]], где структура ячеек соответствует полостям, существующим в известных формах льда. Диапазон воз-можных размеров таких полостей, определяемый как диаметр вписанного шара, в ячейках льда изменяется от Dmax = 0.936 нм до Dmin = 0.780 нм, а размер молекул гостей в известных гидратах изменяется от максимального, равного 0.71 нм для iso-C4H10, до минимального, равного 0.38 нм для Ar. Молекулы Не, Ne и Н2 гидратов обычно не образуют, их малая поляризуемость и размеры (менее 3 нм) приводят к слишком слабому в-д-в взаимодействию гость-хозяин (а описанные недавно в [[67]] гидраты Н2 при 300К стабильны лишь при давлении Р ³ 2.3-5.0 ГПа).
Структура воды за пределами второго слоя клатратной оболочки подобна обыч-ной воде, но жесткая взаимная ориентация молекул воды в клатрате существенно сни-жает энтропию системы, мало влияя на энтальпию. Разрушение такой упорядоченной структуры при повышении температуры повышает энтальпию и энтропию, что объяс-няет аномально высокую теплоемкость таких систем. Ситуация меняется, когда размер аполярных включений превышает критический размер Dmax. В этом случае возможно образование лишь отдельных элементов клатратной ячейки, неизбежны деформации и разрыв части Н-связей. Это повышает энтальпию и снижает отрицательное приращение энтропии. По оценкам, приведенным в обзоре [62], расчетное “межфазное натяжение” на границе раздела вода/неполярное включение при превышении Dmax увеличивается в ~3 раза. В результате молекулярные включения с размерами меньше Dmax образуют стабильные гидраты, а при размере, существенно превышающем Dmax, стремятся для снижения межфазной поверхности сблизиться и объединиться в отдельную фазу или кластеры.
В этом - одно из возможных объяснений эффекта гидрофобного притяжения между частицами. Такое притяжение надежно документировано в модельных экспери-ментах с гидрофобными пластинами, которые разделены узкой щелью, заполненной водой или раствором. Этот эффект не описывается в рамках классических теорий ДЛФО (Дерягин-Ландау-Фервей-Овербек), Дебая, Лифшица и др (см., например, в [37,38,45-47]), но надежно измеряется современной прецизионной техникой [46]. Энергия такого взаимодействия Е удовлетворительно описывается уравнением
Е = - Е0ехр(-Н/l0), (4)
где Н – ширина щели, Е0 и l0 –константы (l0 = 1-2 нм и Е0 = 20-100 мДж/м2) [46]. По интенсивности и дальнодействию эти силы близки кулоновским, но гидрофобное взаи-модействие распространяется на расстояния более 10 нм и явно сильнее аддитивного дисперсионного. Строгое количественное описание такого притяжения пока отсутст-вует, хотя его связь со структурой воды в щели представляется бесспорной [46,54,[68]].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.