Сам Оствальд рассматривал упомянутое правило как достаточно общий закон природы, применимый к широкому кругу явлений, хотя не смог дать ему надежное теоретическое обоснование. Неудачи в общем обосновании правила Оствальда иници-ировали ряд попыток свести его к частным случаям. (см., например, в [164-[168]]). Однако повышение прецизионности эксперимента и современные исследования новых систем подтверждают выполнение правила Оствальда в огромном множестве природных геохимических, лабораторных и промышленных процессов с фазовыми превращениями [[169],[170],[171],[172],[173]].
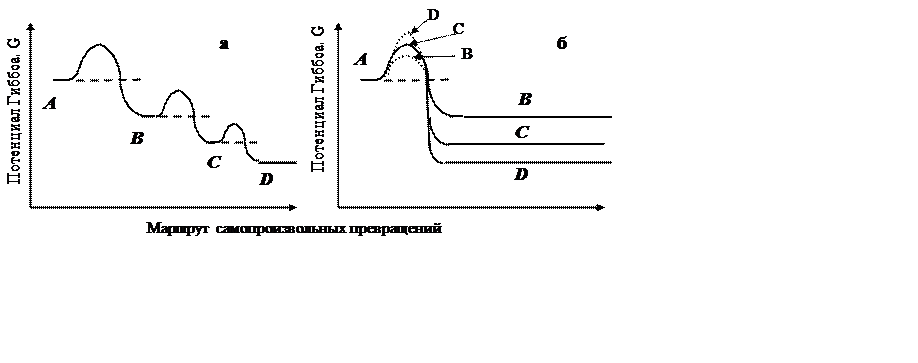
Рис.20. Схема изменений общего потенциала Гиббса G0 системы: а) при последова-тельном переходе от исходной фазы А к наиболее устойчивой фазе D и б) при параллельном образовании фаз В, С иD.
Например, это правило выполняется в последовательности фаз Al2O3, образую-щихся при термическом разложении бемита [[174],[175]]: Al2O3Н2O " g-Al2O3 (-1563.8 кДж/моль) " d-Al2O3 (-1572.9 кДж/моль) " a-Al2O3 (-1582.3 кДж/моль; в скобках даны значения DrG0 для фазовых превращений по [[176],[177]]). Аналогично, при высокотемпе-ратурной (330¸4400С) гидротермальной обработке (ГТО) SiO2 наблюдается последова-тельность превращений: аморфная форма SiO2 (-850.7 кДж/моль) " кристобалит (-855.4 кДж/моль) " тридимит (~-855.6 кДж/моль)" кварц (-856.4 кДж/моль), а более мягкие условия ГТО и введение координаторов ВСГ приводит, например, к последова-тельностям: аморфная фаза " морденит " анальцим " кварц, или фожазит" ZSM-4 и т.д, которые также соответствуют правилу Оствальда [[178]]
Достаточно строгие обоснования правила Оствальда появились только в конце XX века, они основаны на термодинамике необратимых процессов и статистической физике. Так, ван Сантен вывел это правило из условия минимизации производства энтропии при нуклеации менее равновесных форм, доказательство основано на подхо-дах неравновесной термодинамики [169]. Другие обоснования [170,171,[179],[180]] базируются на статистической флуктуационной теории фазовых переходов Ландау-Лифшица-Гинзбурга, первоначально разработанной для описания фазовых переходов второго рода [45,47]. В этой теории изменение термодинамического потенциала при фазовом переходе выражается через изменение степени упорядоченности (или симметрии). Например, оксиды ряда g-Al2O3 " d-Al2O3 "a-Al2O3 отличаются расположением ионов Al, которые в g и d формах распределены по тетраэдрическим и октаэдрическим полостям плотнейшей упаковки из ионов кислорода, а a-форме находятся только в октаэдрических полостях. Соответственно, переход g"d"a сопровождается ростом симметрии кристалла с одновременным увеличением значений DrG0. Из проведенного обсуждения следует прямая связь последовательности фазовых превращений с структурной упорядоченностью.
Правило ступенчатых переходов Оствальда тесно связано с другим таким же общим, но, к сожалению, также часто игнорируемым правилом Пиллинга-Бедворта, которое характеризует объемные изменения при твердофазных переходах.
2.2. Правило объемных соотношений Пиллинга-Бедворта
В синтезе и при эксплуатации гетерогенных катализаторов и других пористых материалов распространены твердофазные реакции типа
аАтв " bВтв + С1, (XIII. 1);
аАтв + С2 " bВтв (XIII. 2);
аАтв + С3 " bВтв + С4 (XIII.3),
где А и В – твердофазные компоненты, а Сi – относительно легко удаляемые газообраз-ные или жидкие компоненты (флюиды). В более общем виде эти реакции можно запи-сать как стехиометрическую трансформацию а молей твердой фазы А в b молей твердой фазы В:
аАтв " bВтв, (XIV)
Типичные примеры реакций типа (XIII. 1) - термическое разложение кристаллогидра-тов, гидроксидов, гидридов или солей типа карбонатов, нитратов, оксалатов, сюда же можно отнести пиролиз активных углей, экстракцию части компонентов твердой фазы и т.д. Реакции типа (XIII. 2) происходят при окислении, карбонизации, сульфидирова-нии, фторировании и других процессах химического поглощения газов твердыми реагентами, примеры реакции (XIII. 3) – восстановление оксидов с образованием паров воды или гидролиз гидридов с выделением водорода.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.