Пример расчёта энтальпии.
Пусть требуется рассчитать изменение энтальпии меди при нагреве от твёрдого состояния p = 100 атм, Т = 1200 К до Т=1400 К, p = 1 атм.
Решение:
 Энтальпия – это функция состояния,
поэтому её значение не зависит от пути, по которому система переходит из одного
состояния в другое. Пусть процесс осуществляется так, как это показано на
диаграмме рис. 2.2.
Энтальпия – это функция состояния,
поэтому её значение не зависит от пути, по которому система переходит из одного
состояния в другое. Пусть процесс осуществляется так, как это показано на
диаграмме рис. 2.2.
В этом случае можно записать (учтено, что температура плавления меди Тпл = 1357 К и, следовательно, Н1400 = Н1400 (ж, р = 1 атм))
ΔН = Н1400(ж,p = 1 атм) – Н1200(тв, p = 100 атм) = Н14000 – Н12000 + Н12000 – Н12000(p = 100 атм) = (Н14000 – Н2980) – (Н12000 – Н2980) - [Н12000 (тв, p = 100 атм) – Н12000]
(а) (б) (в)
Искомая величина
ΔН = (а) – (б) – (в)
Два первых члена можно найти из справочников:
(а) = 43 806 Дж/моль;
(б) = 24 490 Дж/моль;
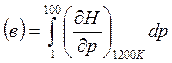 (2.16)
(2.16)
Далее будет показано, что
(∂Н/∂p)Т= V (1 - αT),(2.17)
здесь V – объём 1 моля меди в твёрдом состоянии, a - коэффициент термического расширения.
Так как Т – постоянна, а изменением объёма при изменении давления для твёрдого тела можно пренебречь, то, подставляя в (2.16) значение производной из (2.17) при Т=1200 К, можно получить
(в) = 80 Дж/моль, тогда ΔН = (а) - (б) - (в) = 43 806 – 24 490 – 80 = 19 230 Дж/моль.
2.4. Теплоты реакций. Закон Гесса. Закон Кирхгоффа
Если стехиометрическое уравнение реакции записывается в виде
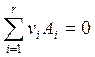 (2.18)
(2.18)
νi > 0 – для продуктов реакции; νi < 0 – для реагентов, то теплота реакции
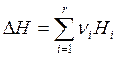 , (2.19)
, (2.19)
Hi – мольная энтальпия вещества Аi.
Если ΔН > 0, то теплота поглощается системой, и говорят, что реакция эндотермическая, если ΔН < 0, то система выделяет теплоту, и говорят, что реакция экзотермическая.
В частности, если имеем
x A + y B
= Ax By, обозначим А = А1, В =
А2, АхВy = А3, тогда ν1 = -x,
ν2 = -y,
![]() .
.
Следовательно, ΔН = Н(АxВy) – xH(A) – yH(B)
Если вещество в стандартном состоянии, то
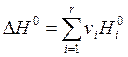 . (2.20)
. (2.20)
ΔН (или ΔН0) – это теплота реакции, которая выделяется в результате реакции при полном превращении νi молей реагента Аi (где i = 1, ….k) в νi продуктов Аi (где i = k + 1, …r), т.е.

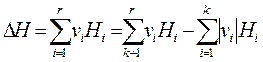 (2.21)
(2.21)
(Необходимо помнить νi> 0 – для продуктов реакции; νi < 0 – для исходных продуктов).
Соотношение (2.19) или (2.21) выражают закон Гесса, в соответствии с которым (1840 г.) тепловой эффект реакции не зависит от пути процесса (набора промежуточных стадий), а определяется только начальным и конечным состоянием системы (это следствие того, что Н – функция состояния).
На практике в системе, содержащей ni молей разных веществ Аi (i = 1, …r), часто оказывается, что реакция не протекает полностью.
Если ввести в рассмотрение величину ξ, называемую степенью полноты реакции (или химической переменной, или координатой реакции), с помощью соотношения
(n1 – n10)/ν1 = (n2 – n20)/ν2 = …………= (nr – nr0)/νr = ξ
или
dn1/ν1 = dn2/ν2 = ……… = dnr/νr = dξ ,(2.22)
здесь индекс «0» означает начальное состояние системы, то можно записать универсальное соотношение, которое будет справедливо как в случае полного протекания реакции, так и неполного.
Действительно, энтальпия системы, содержащей ni молей вещества (компонента) Аi (i = 1…r),
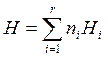 . (2.23)
. (2.23)
При p = const, T = const изменение энтальпии системы ΔНs в результате реакции
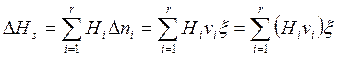 (2.24)
(2.24)
Или, так как в соответствии с (2.22) dni = νi dξ
dHs = ΔH dξ (2.25)
Т.е. увеличение энтальпии системы – это произведение теплоты протекающей реакции ΔН на степень полноты её протекания (координаты реакции).
Необходимо отметить, что, если:
dξ > 0 – имеет место прямая реакция (число молей продуктов возрастает, реагентов уменьшается);
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.