Могут быть две различные ситуации, показанные на рис. 10.4 (а, б).
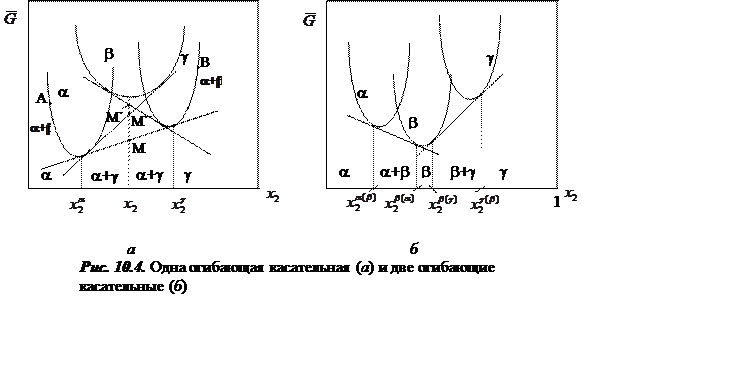
Случай «а».
Проведены касательные к каждой паре кривых ![]() В данном случае (рис. 10.4, а)
кривая
В данном случае (рис. 10.4, а)
кривая ![]() не пересекает
касательную
не пересекает
касательную ![]()
![]() следовательно,
любая точка на касательных
следовательно,
любая точка на касательных ![]() и
и
![]() (точки M´ и М´´) будет находиться выше точки М.
Следовательно, состояния, в которых будет присутствовать фаза b, будуть метастабильными (устойчивыми только
к малым колебаниям) или вообще неустойчивыми
(точки M´ и М´´) будет находиться выше точки М.
Следовательно, состояния, в которых будет присутствовать фаза b, будуть метастабильными (устойчивыми только
к малым колебаниям) или вообще неустойчивыми
Случай «б».
Кривая ![]() (см рис.10.4)
пересекает касательную
(см рис.10.4)
пересекает касательную ![]() .
В этом случае в зависимости от концентрации
.
В этом случае в зависимости от концентрации ![]() можно иметь состояния, в которых
присутствуют только a, a + b,
b, b
+ g и g.
можно иметь состояния, в которых
присутствуют только a, a + b,
b, b
+ g и g.
Приведенные
построения справедливы для систем с любым числом фаз. При этом для определения
энергии Гиббса системы в ее наиболее стабильном равновесном состоянии можно
использовать простое правило: молярная Энергия Гиббса системы в ее наиболее
стабильном равновесном состоянии изменяется по кривой, совпадающей с туго натянутой
струной, огибающей кривые ![]() , закрепленной в точках
А и В на крайних левых и правых кривых
, закрепленной в точках
А и В на крайних левых и правых кривых ![]() .
.
10.4 Две фазы в бинарной системе, представляющие идеальные растворы
Анализ равновесий тв – ж, тв1 – тв2, ж – газ идентичен.
Рассмотрим систему тв – ж.
Пусть
характерные зависимости ![]() для этой системы
соответствуют рис. 10.5.
для этой системы
соответствуют рис. 10.5.
На рис.10.5 температура от «а»
к «д» уменьшается. При высоких Т ![]() при всех
при всех ![]() - жидкое состояние более устойчиво.
С понижением температуры
- жидкое состояние более устойчиво.
С понижением температуры ![]() ,
при
,
при ![]() (рис. 10.5, б).
Дальнейшее снижение температуры приводит к ситуации, когда кривые
(рис. 10.5, б).
Дальнейшее снижение температуры приводит к ситуации, когда кривые ![]() и
и ![]() пересекаются (рис. 10.5, в).
В этом случае можно провести общую касательную, которая даст точки
пересекаются (рис. 10.5, в).
В этом случае можно провести общую касательную, которая даст точки ![]() и
и ![]() , определяющие равенство химических
потенциалов веществ 1 и 2 в твердом и жидком растворах.
, определяющие равенство химических
потенциалов веществ 1 и 2 в твердом и жидком растворах.
При ![]() - жидкость,
- жидкость, ![]() - тв +
ж,
- тв +
ж, ![]() - тверд.
- тверд.
Дальнейшее снижение температуры (рис. 10.5, г) ![]() только при
только при ![]() .
.

При более
низких температурах вся кривая ![]() оказываетсят
над
оказываетсят
над ![]() - твердое состояние более
устойчиво при всех
- твердое состояние более
устойчиво при всех ![]() .
.
Фазовая диаграмма, отражающая зависимость состава от температуры, для рассматриваемой системы представлена на рис.10.5, е. Здесь 1 - линия ликвидуса, 2-линия солидуса.
Для идеальных растворов (растворы, для которых аi = хi ) линии ликвидуса и солидуса могут быть определены аналитически.
Согласно (10.8)
в случае равновесия ![]() . Положив
. Положив ![]() (влияние
давления для жидких и твердых сред невелико; * - состояние сравнения, 0 -
стандартное состояние), можно записать, учитывая, что
(влияние
давления для жидких и твердых сред невелико; * - состояние сравнения, 0 -
стандартное состояние), можно записать, учитывая, что
![]()
![]() . (10.12)
. (10.12)
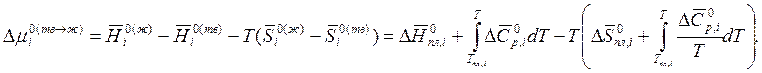 (10.16) (10.13)
(10.16) (10.13)
Опустим для простоты записи черту над символами, обозначающими молярные свойства.
Будем
рассматривать случай, когда ![]() . В этом случае
. В этом случае
![]() , (10.14)
, (10.14)
где ![]() и
и ![]() - изменения энтальпии и энтропии в
результате фазового перехода (при температуре плавления).
- изменения энтальпии и энтропии в
результате фазового перехода (при температуре плавления).
При ![]() ,
, ![]()
![]() , (10.15)
, (10.15)
откуда
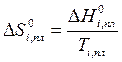 . (10.16)
. (10.16)
Подставляя (10.16) в (10.14), получаем
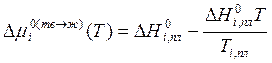 . (10.17)
. (10.17)
Учитывая (10.17), из (10.12) для i = 1 получим
![]() . (10.18)
. (10.18)
Так как
растворы идеальны ![]() (
(![]() -
мольная доля компонента 1), то с учетом (10.18) получим
-
мольная доля компонента 1), то с учетом (10.18) получим
![]() . (10.19)
. (10.19)
Соответственно, для ![]() , аналогично
, аналогично
![]() (10.20)
(10.20)
Так как ![]() (по
определению
(по
определению 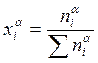 ,
, ![]() ), то,
складывая (10.19) и (10.20), получаем уравнение линии солидуса:
), то,
складывая (10.19) и (10.20), получаем уравнение линии солидуса:
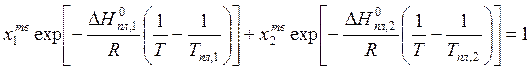 . (10.21)
. (10.21)
Выражая из
(10.19), (10.20) ![]() и
и ![]() и учитывая,
что
и учитывая,
что ![]() , получаем уравнение линии ликвидуса
, получаем уравнение линии ликвидуса
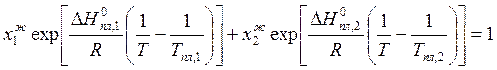 . (10.22)
. (10.22)
Системы, которые не сильно отклоняются от идеальных, имеют качественно аналогичные зависимости.
Интересно
оценить интервал ![]() между линиями ликвидуса и
солидиуса в сечении
между линиями ликвидуса и
солидиуса в сечении 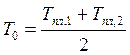 . Если предположить, что
. Если предположить, что ![]() (это часто хорошо выполняется), то,
учитывая (10.16), можно получить, что
(это часто хорошо выполняется), то,
учитывая (10.16), можно получить, что
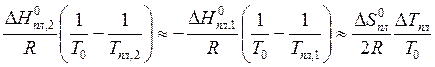 , (10.23)
, (10.23)
где ![]() .
.
|
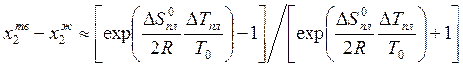 . (10.24)
. (10.24)
Имея ввиду, что
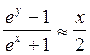 (из разложения в ряд Тейлора, 1-е
приближение), можно записать
(из разложения в ряд Тейлора, 1-е
приближение), можно записать
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.