dξ < 0 – протекает обратная реакция (число молей продуктов убывает).
Знак dξ зависит от температуры, давления и концентраций компонентов в реакционной смеси.
Вопрос о расчёте направления и степени полноты реакции будет рассмотрены позже.
ΔH > 0 – реакция эндотермическая, ΔН < 0 – реакция экзотермическая.
Пример расчёта изменения состава и энтальпии системы в результате химической реакции.
Пусть протекает реакция образования карбида кальция
Ca + 2 C = CaC2, ΔH2980= - 62,7 кДж.
Исходное состояние системы n10 = 2 моль, n20 = 3 моль, n30 = 1моль.
Требуется определить ξ, n1, n2, n3, ΔHS после завершения реакции (реакция проходит до конца).
Решение: конечное содержание веществ [см. (2.22)]
n1 = n10 – ξ , n2 = n20 – 2 ξ , n3 = n30 + ξ , (ν1 = - 1, ν2 = - 2, ν3 = 1), так как реакция протекает до конца, то одно из веществ {n1, n2} израсходуется полностью, т.е.
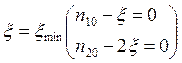 , следовательно, ξ = 1,5.
, следовательно, ξ = 1,5.
При этом n1 = 0,5, n2 = 0, n3 = 2,5, ΔНS = ξ ΔH0 = - 1,5 · 62,7 = - 94,05 кДж (теплота, поглощаемая системой), реакция экзотермическая, т.к. ΔН0 < 0
Следует отметить, что энтальпия реакции зависит от температуры.
При постоянном давлении (p = const)
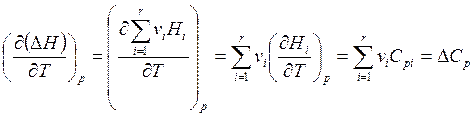 , т.е.
, т.е.
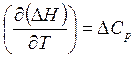 (2.26)
(2.26)
Это закон Кирхгоффа.
2.5. Теплоты образования вещества (Нf)
Абсолютную энтальпию вещества определить невозможно, поэтому вводят стандартную теплоту образования вещества. Это стандартная теплота реакции при образовании соединения в стандартных условиях из простых веществ, находящихся в стандартных состояниях.
Например,
С(графит) + ½ О2(газ) = СО(газ) (2.27)
Нf0 (CO) = ΔH0 = H0(CO) – H0 (C графит) – 1/2H0(O2) . (2.28)
Теплота образования обозначается индексом «f».
Очевидно, что стандартная теплота образования элемента в его стандартном состоянии равна 0.
Энтальпию реакции можно выразить через теплоты образования:
в стандартных условиях
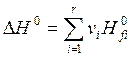 , (2.29)
, (2.29)
в общем случае ![]() . (2.30)
. (2.30)
Эти уравнения – следствие того, что Н – функция состояния, т.е. ΔН не зависит от пути перехода из одного состояния в другое. Поэтому ΔН можно вычислить, проходя из состояния (1) в (2) через состояние (3) (рис. 2.3), в котором все реагенты разложены на составляющие их простые вещества (элементы).
![]()
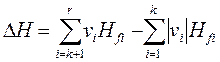 (2.31)
(2.31)
Пример
CO + H2O = CO2 + H2 (2.32)
ΔH0 = Hf0(CO2) - Hf0(CO) - Hf0(H2O) . (2.33)
Все Нfi0 – из справочника.

Если определить теплоту сгорания (ΔHсг) как теплоту, которая выделяется при полном окислении вещества (до высших оксидов СО2, Н2О и т.д.), то теплоты образования или теплоты реакций можно рассчитывать по известным теплотам сгорания исходных реагентов и продуктов рассматриваемой реакции. Действительно, состояние (3) на рассмотренной выше схеме можно определить и как состояние полного окисления исходных продуктов (1) или состояние полного окисления продуктов реакций (2).
В этом случае
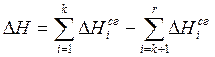 , (2.34)
, (2.34)
i = 1, …, k – исходные реагенты, i = k+1, …, r – продукты реакции.
3. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Как было сказано выше, обратимый (равновесный, квазистатический) процесс – процесс, при котором в каждый момент времени система имеет бесконечно малое отклонение от равновесия (бесконечно малое изменение внешних условий может изменить направление процесса на обратное).
Необратимый процесс – процесс, не удовлетворяющий условиям обратимого процесса.
Все реальные процессы – необратимые, но многие из них часто можно рассматривать как обратимые. Всё зависит, насколько сильно отклонение от равновесия сказывается на процессе система.
Второй закон термодинамики определяет направление процесса и чрезвычайно важен при анализе равновесных состояний системы, предсказании возможности существования той или иной фазы и т.д.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.