Получается,
если в (3.36) положить ![]() .
.
4) Если
положить в (3.34) ![]() , то
, то 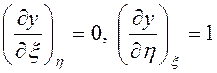 и
получается
и
получается
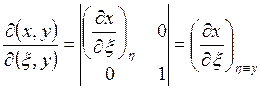 . Аналогично
. Аналогично 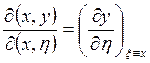 (3.38)
(3.38)
Определение (3.34) и основные свойства якобианов (3.35)-(3.38) будут полезны в дальнейшем при определении и вычислении различных функций состояния и термодинамических коэффициентов.
Рассмотрим термодинамический процесс с произвольной, но постоянной теплоемкостью – политропический процесс. Имеем [см (2.5), (2.7)]
![]() ,
, 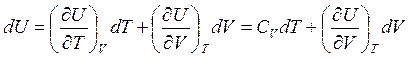 . (3.39)
. (3.39)
Вычислим
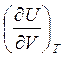 , учитывая, что
, учитывая, что 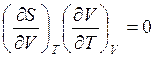 , т.к.
, т.к.
![]()
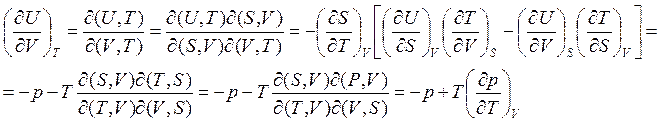 (3.40)
(3.40)
При выводе (3.40) были использованы выражения, следующие из (3.14):
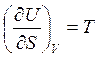 ,
, 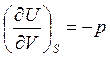 (3.41)
(3.41)
Подставив в (3.39) выражение для первого закона термодинамики (2.1) и формулу (3.40), получим
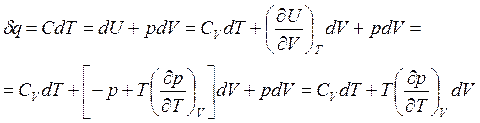 (3.42)
(3.42)
Следовательно,
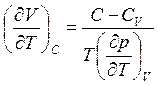 (3.43)
(3.43)
Если известно уравнение состояния p = p(T,V), то уравнение (3.43) может быть проинтегрировано, что приводит к уравнению политропы T = T(V). Используя уравнение состояния, последнюю зависимость можно представить в виде p = p(V), либо T = T(p).
Проделаем процедуру интегрирования для совершенного газа (pV = RT, CV = const). Уравнение (3.43) принимает вид:
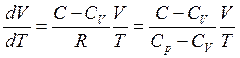 или
или 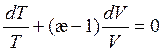 , (3.44)
, (3.44)
где постоянная величина æ называется показателем политропы
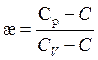 . (3.45)
. (3.45)
Интегрируя (3.44), получаем уравнение политропы TVæ-1 = const или (с учетом уравнения состояния) pVæ = const или T-æ pæ-1 = const.
Энтропия и энтальпия совершенного газа
Определим энтропию и энтальпию как функцию термодинамических параметров. Из уравнения (3.14) для дифференциала внутренней энергии выражается дифференциал энтропии
![]() (3.46)
(3.46)
С учетом
уравнения состояния идеального газа (1.5) и выражения ![]() для
внутренней энергии совершенного (CV
= const) газа (3.46) переходит в
для
внутренней энергии совершенного (CV
= const) газа (3.46) переходит в
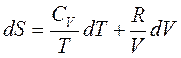 (3.47)
(3.47)
Интегрируя (3.47), получаем
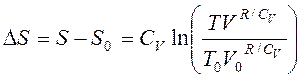 (3.48)
(3.48)
Из (3.48) можно поучить выражение для внутренней энергии совершенного газа как функции собственных переменных (S, V):
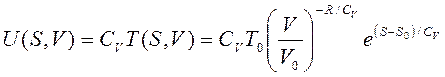 (3.49)
(3.49)
Используя уравнение состояния, можно выразить изменение энтропии (3.48) через другие пары параметров:
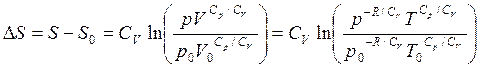 (3.50)
(3.50)
Энтальпия идеального газа
![]() (3.51)
(3.51)
Энтальпия совершенного газа
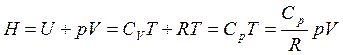 (3.52)
(3.52)
Изобарический
процесс ![]() ,
, ![]() ,
, ![]() ,
, ![]() – закон
Гей-Люссака. В этом случае из (3.50) процесс удобно представить в виде (3.54):
– закон
Гей-Люссака. В этом случае из (3.50) процесс удобно представить в виде (3.54):
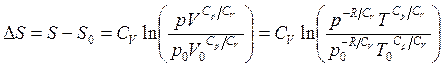 (3.53)
(3.53)
![]() (3.54)
(3.54)
Изотермический
процесс ![]() ,
, ![]() ,
, ![]() ,
, ![]() - закон
Бойля -Мариотта.
- закон
Бойля -Мариотта.
Адиабатический
процесс ![]() ,
, ![]() (показатель
адиабаты),
(показатель
адиабаты), ![]() ,
, ![]() ,
, ![]() - закон Пуассона.
- закон Пуассона.
Изохорический
процесс ![]() ,
, ![]() ,
, ![]() ,
, ![]() -
закон Шарля (самый древний, выведен в 17 веке). Для (T,
S)-координат из (3.50) процесс представляется в
виде (3.56):
-
закон Шарля (самый древний, выведен в 17 веке). Для (T,
S)-координат из (3.50) процесс представляется в
виде (3.56):
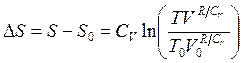 (3.55)
(3.55)
![]() (3.56)
(3.56)
Все эти процессы можно представить на рабочей (рис. 3.2) и тепловой (рис. 3.3) диаграммах.
|
Рис.3.2. рV – диаграмма |
|
Рис.3.3. TS - диаграмма |
Из определения показателя политропы (3.45) следует:
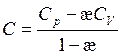 (3.57)
(3.57)
Из (3.57) следует, что положительные теплоемкости C > 0 имеют место при -¥ < æ < 1 и g < æ < ¥, а интервал 1 < æ < g соответствует отрицательным теплоемкостям.
3.4. Основные соотношения термодинамики закрытой системы (работа связана только с преодолением внешнего давления: dw = pdV)
Мы видели, что использование той или иной термодинамической функции при осуществлении того или иного процесса позволяет получить наиболее простые соотношения, описывающие изменение системы. Такого рода функции называются характеристическими. Более точно:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.