тогда, решая систему уравнений (6.54), (6.56), (6.58)
относительно ![]() ,
, ![]() и
подставляя в (6.52), можно получить:
и
подставляя в (6.52), можно получить:
![]() (6.59)
(6.59)
Итак, для того чтобы определить равновесные концентрации веществ, необходимо:
¨ решить вопрос о том, какие индивидуальные вещества надо рассматривать при решении задачи (пусть число этих веществ будет m) и какие и сколько химических элементов входят в состав рассматриваемой системы (пусть их будет l);
¨ рассмотреть r уравнений диссоциации (r = m - l) и r соответствующих уравнений, выражающих закон действия масс для каждой реакции (или r других независимых уравнений реакций)
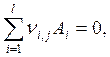 j = 1 … r (6.60)
j = 1 … r (6.60)
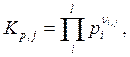 j = 1 … r; (6.61)
j = 1 … r; (6.61)
¨ в систему уравнений термодинамического равновесия для идеальной газовой смеси необходимо включить также закон Дальтона:
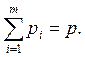 (6.62)
(6.62)
Для замыкания системы уравнений необходимо записать ещё (n - 1) уравнений материальных балансов (неизменность отношения числа атомов разного типа в смеси в исходном и равновесном состояниях):
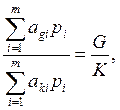 (6.63)
(6.63)
где аgi и aki – количество атомов вида g и k соответственно в молекуле i-того вещества; G и К – суммарные количества атомов вида g и k в исходных реагентах (G/K - отношение чисел атомов вида g и k в исходных продуктах).
Уравнения материального баланса (6.63) записаны с учётом того, что 1 моль любого вещества содержит одинаковое количество молекул, равное числу Авогадро (А), а величина рi /р - доля молекул вида i от общего числа молекул в реакционной смеси.
Таким образом, имеется:
▸ m - l уравнений (6.61);
▸ 1 уравнение (6.62);
▸ l - 1 уравнений (6.63);
▸ Всего m – l + 1 + l – 1 = m уравнений для определения m значений парциальных давлений, т.е. задача может быть решена.
|
▸ закон действия масс
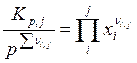 j = 1 … r (6.64)
j = 1 … r (6.64)
▸ закон Дальтона
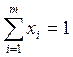 ; (6.65)
; (6.65)
▸ уравнение баланса элементов в реакционной смеси
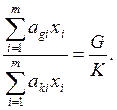 (6.66)
(6.66)
В случае, если требуется перейти к числам молей соответствующих компонентов ni = хin (n-общее число молей реакционной среды), то необходимо добавить еще одно уравнение, выражающее равенство числа атомов каждого вида до реакции и после реакции и позволяющее определить n:
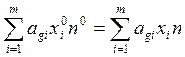 . (6.67)
. (6.67)
Пример: диссоциация водорода
H2 Û 2 H. (6.68)
Введем обозначения: нижний индекс i-номер компонента;
H2 – i = 1, H – i = 2. (6.69)
Уравнения:
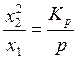 ,
(6.70)
,
(6.70)
![]() ,
(6.71)
,
(6.71)
![]() .
(6.72)
.
(6.72)
Изменение объема
b=n/n0=2x1/(2x1+x2). (6.73)
В данном случае имеется три уравнения для определения трех неизвестных х1, х2, b.
7. Равновесия ФАЗ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ (ЗАКРЫТЫЕ СИСТЕМЫ)
Пусть имеем чистое однокомпонентное вещество (например, железо или СО2 или любое другое). Известно, что вещество может быть твёрдым, жидким или газообразным; в твёрдом состоянии вещество может находиться в различных кристаллических состояниях. Все эти различные состояния называются фазами. Область существования каждой фазы вполне определённая (в определённом диапазоне температур и давлений).
7.1. Фазовые переходы первого и второгорода
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.