- для обратимого процесса dU – TdS+ pdV = 0. (3.14)
Условием равновесия (обратимости) процесса, очевидно, является нарушение неравенств (3.13), (3.14) в случае протекания процесса, отклоняющего систему от равновесия.
Таким образом, термодинамический критерий равновесия для закрытых систем можно записать как
δS ≤ δq/T, (3.15)
где δ – означает виртуальное (предположительное) изменение термодинамических функций или параметра.
Уравнение (3.15) эквивалентно следующему:
δZ = δU – T δS + p δV ≥0 (3.16)
или
δZ ≥ 0 (3.17)
где
δZ = δU – T δS + p δV(3.18)
(δZ - вводится для удобства записи).
В зависимости от ограничений, накладываемых на систему, её описание целесообразно проводить, оперируя тем или иным набором термодинамических параметров и функций.
1. В частности, если в качестве термодинамических параметров (переменных) используются (S, p), то оперируют с энтальпией
Н = U + pV (3.19)
![]() (3.20)
(3.20)
Это связано с тем, что в этих координатах с помощью функции энтальпии многие свойства системы можно выразить в явном виде.
В
частности, если S, p
= const, то ![]() и в качестве критерия
равновесия можно рассматривать
и в качестве критерия
равновесия можно рассматривать
![]() (3.21)
(3.21)
Действительно,
![]()
![]()
откуда
![]()
И,
следовательно, в случае p, S = const ![]()
![]() (3.22)
(3.22)
Т.е. условие равновесия для равновесного (обратимого) процесса:
![]() (3.23)
(3.23)
Для необратимого процесса:
![]() .
.
2. Если в качестве термодинамических параметров используются (T, V),то в рассмотрение вводится термодинамическая функция состояния
А = U – TS, (3.24)
называемая энергией Гельмгольца.
Легко убедиться, что в этом случае при Т, V = const критерием равновесия является
![]() (3.25)
(3.25)
Для равновесного процесса
![]() (3.26)
(3.26)
![]() (3.27)
(3.27)
Откуда следует, что при V,T = const
(dA)T, V = 0. (3.28)
Из (3.18) с учетом (3.26) следует
![]() .
.
Или ![]() .
.
3. Если в качестве термодинамических переменных используются (p, T), то вводят термодинамическую функцию состояния
G = U + pV – T S(3.29)
называемую свободной энергией Гиббса
![]()
В случае p, Т = const с учетом (3.18)
![]()
Отсюда следует, что в случае p,Т = const критерием термодинамического равновесия является
![]() . (3.30)
. (3.30)
В случае равновесного (обратимого) процесса
![]() (3.31)
(3.31)
или с учетом (3.14)
![]() (3.32)
(3.32)
откуда для равновесного процесса
![]() . (3.33)
. (3.33)
Замечание. При выводе критериев предполагалось, что работа w связана только с действием давления и изменением объёма системы (dw = pdV). В общем случае могут быть другие виды работ, тогда dw будет другим.
3.3. Политропические процессы
Рассмотрим переход от пары независимых переменных (x, y) к паре (x, h). Вводится понятие функционального определителя (якобиана), который обозначается и определяется следующим образом:
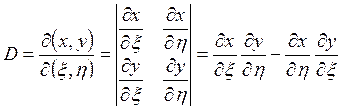 (3.34)
(3.34)
Геометрический смысл якобиана D заключается в том, что он представляет собой коэффициент изменения элементарной площади при переходе от (x, y) - плоскости к (x, h) - плоскости:
![]()
Основные свойства якобианов
1) 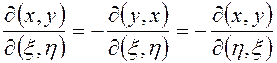 (3.35)
(3.35)
(3.35) следует из определения (3.34).
2) 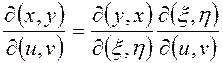 (3.36)
(3.36)
Теорема умножения. Вытекает из правил дифференцирования сложной функции.
3) 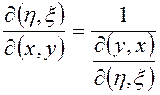 (3.37)
(3.37)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.