Существует функция состояния, называемая энтропией S, которая определяется, как:
- для любого самопроизвольного обратимого процесса
dS = δqобр./T, (3.1)
- для любого необратимого процесса
dS > δq/T. (3.2)
Для изолированной системы δq = 0, следовательно, для изолированной системы Sвсегда возрастает (неравновесный процесс) или остаётся равной нулю (равновесный процесс).
Энтропия является мерой необратимости процесса или мерой разупорядоченности системы.
Примеры самопроизвольных необратимых процессов:
1) передача тепла от более горячего тела к более холодному;
2) превращение работы в теплоту (например, в результате трения).
3.1. Равновесие. Стабильность (устойчивость) равновесия
Определение равновесного состояния дано в п.п. 2.1. Иными словами, термодинамическое равновесие – это состояние термодинамической системы, в которое система приходит самопроизвольно в отсутствии внешних воздействий, и из которого система не может выйти без воздействия извне.
Равновесие может быть устойчивым или неустойчивым по отношению к малым или большим возмущениям параметров, характеризующих условие равновесия.
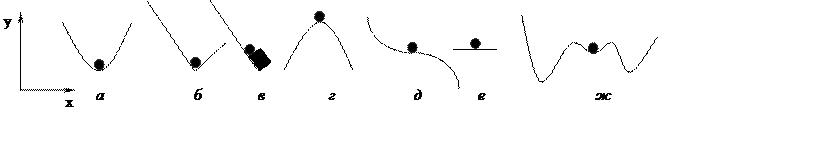
В качестве примеров можно показать следующие различные виды равновесий шара на криволинейной поверхности (рис. 3.1).
 |
|||
|
|||
Для всех случаев, кроме «б» и «в», первая производная y(x) по x, т.е. yx¢ = 0.
Случаи «б» и «в» соответствуют системе с дополнительными ограничениями.
Если равновесие системы характеризуется некоторым свойством G(ξ), то условием равновесия, очевидно, является следующее
![]() (3.3)
(3.3)
Это условие можно заменить на
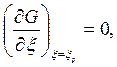 (3.4)
(3.4)
где x - это один из параметров, по которому возможно отклонение от равновесия (переменная, от которой зависит G).
Условие (3.4) можно использовать как условие равновесия, но не устойчивости.
Если DG = G – Gравн - малые отклонения, то можно утверждать, что, если
DG > 0 – равновесие устойчивое, (3.5)
DG = 0 – равновесие нейтральное, (3.6)
DG < 0 – равновесие неустойчивое. (3.7)
Если G не имеет разрыва, то, разложив G в ряд Тейлора в окрестности точки равновесия, получим
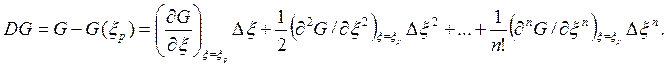 (3.8)
(3.8)
Опираясь
на условия (3.5 – 3.7), можно показать, что, так как ![]() всегда,
то условием устойчивого равновесия является
всегда,
то условием устойчивого равновесия является
![]() (3.9)
(3.9)
Равновесие
является нестабильным, если имеет место обратное неравенство. Если ![]() то необходимо исследовать производные
более высокого порядка. Если
то необходимо исследовать производные
более высокого порядка. Если ![]() а
а 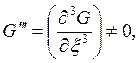 то равновесие неустойчивое, т.к. всегда
можно найти
то равновесие неустойчивое, т.к. всегда
можно найти ![]() с таким знаком, чтобы было DG < 0.
с таким знаком, чтобы было DG < 0.
![]() то DG
> 0, (т.е. равновесие устойчивое), если
то DG
> 0, (т.е. равновесие устойчивое), если ![]() поскольку
поскольку
![]() > 0 и т.д.
> 0 и т.д.
Точка,
в которой ![]() , называется точкой спинодали. Спинодальная
точка разделяет две области с различной кривизной
, называется точкой спинодали. Спинодальная
точка разделяет две области с различной кривизной ![]() .
.
 Точка спинодали если
Точка спинодали если ![]() ,
(3.10)
,
(3.10)
Критич.
точка необходимо, чтобы ![]() .
(3.11)
.
(3.11)
В этом случае условием устойчивости будет
![]() и т.д. (3.12)
и т.д. (3.12)
3.2. Критерии равновесия (однокомпонентные системы), энергии Гельмгольца А (Т,V) и Гиббса G (р, T), энтальпия H (S, р)
Комбинируя (3.2) – второй закон и (2.1) – первый закон, второй закон термодинамики можно записать в виде
- для необратимого процесса dU – TdS + δw < 0,
- для обратимого процесса dU – TdS + δw = 0. (3.13)
Если работа связана только с преодолением сил внешнего давления (δw = + pdV), то:
- для необратимого процесса dU – TdS + pdV < 0,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.