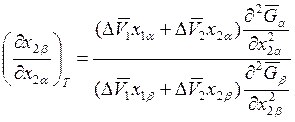 . (8.27)
. (8.27)
Если р = const, то
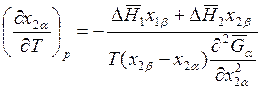 ; (8.28)
; (8.28)
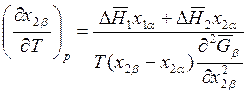 ; (8.29)
; (8.29)
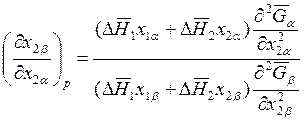 . (8.30)
. (8.30)
Необходимо отметить, что в уравнениях (8.22) – (8.30) использованы парциальные молярные величины и реальные давления. Однако можно построить и иной подход к описанию кривых фазового равновесия с использованием понятий активности и стандартных молярных величин.
Ранее в п. 5.5 были рассмотрены два подхода к определению химических потенциалов конденсированных тел, основанных на введении понятий стандартного состояния и состояния сравнения. В принципе, можно использовать оба подхода. Однако применение уравнения (5.74) более удобно, так как фазовые равновесия обычно исследуются в широких диапазонах концентраций, на концах которых находятся чистые вещества, для которых величины активности можно принять равными единице. Таким образом, химические потенциалы μiα и μiβ запишем в соответствии с (5.74). Приравняв их, получим
![]()
или
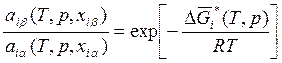 , (8.31)
, (8.31)
где
![]() .
.
Уравнение (8.31) описывает равновесие в интегральной форме. Чтобы получить из него уравнение в дифференциальном виде, возьмем дифференциал от обеих его частей, предварительно перейдя к логарифмической форме:
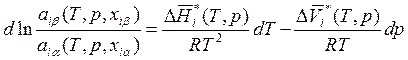 , (8.32)
, (8.32)
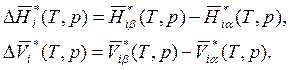
Напомним, что величины ![]() и
и ![]() представляют
собой стандартные изменения энтальпии и объема для чистых веществ в условиях Т
= Т(системы) и р = р(системы). Поэтому они не зависят от
состава.
представляют
собой стандартные изменения энтальпии и объема для чистых веществ в условиях Т
= Т(системы) и р = р(системы). Поэтому они не зависят от
состава.
Интегрируя выражение (8.32), получаем
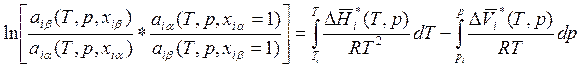 , (8.33)
, (8.33)
где Тi и рi – некоторые выбранные за начало отсчета температура и давление. При изучении равновесий жидкость – пар обычно в качестве температуры Тi берут ту температуру, при которой давление паров над чистой i-й жидкостью равно заданному р, а в качестве давления рi берут давление насыщенных паров над чистой жидкостью при заданной температуре Т. Величины активностей для чистых веществ обычно полагают равными единице. Таким образом, уравнение (8.33) можно записать так:
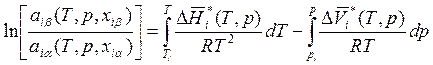 . (8.34)
. (8.34)
Последнее уравнение позволяет рассчитывать зависимости состава фаз от температуры при р = const и от давления при Т = const. Отметим, что правовая часть (8.34) не зависит от состава. Следовательно, и отношение активностей компонента в обеих фазах не зависит от состава. Примеры, иллюстрирующие применение этого подхода, будут приведены в следующей главе.
9. ТЕРМОДИНАМИКА РАСТВОРОВ
Данная глава посвящена описанию термодинамики и ряда свойств жидких и твердых растворов. Для этого вида смесей характерна возможность сосуществования с газовой фазой, и поэтому их поведение обладает рядом специфических особенностей, что и позволяет выделить данное рассмотрение в отдельный раздел. Изложение материала проведено в основном на примере жидких растворов. Однако это не исключает приложения основных выводов и к твердым растворам, для которых установление равновесий осуществляется, конечно, намного медленнее, чем в жидкости из-за малой подвижности вещества в твердой фазе. Особенно важны такие приложения для твердых растворов, получаемых при затвердевании жидких расплавов, соосаждения или сокристаллизации из жидких растворов и т.д.
9.1. Классификация растворов
Общепринята следующая классификация растворов на основе представлений об избыточных термодинамических функциях:
![]() ,
, ![]() ,
, ![]() ;
;
![]() ,
, ![]() ,
, ![]() ;
;
![]() ,
, ![]() ,
, ![]() ;
;
![]() ,
, ![]() ,
, ![]() , где
, где ![]() -
избыточная молярная функция смешения (отклонение реальной величины от величины
функции смешения для идеальной системы)
-
избыточная молярная функция смешения (отклонение реальной величины от величины
функции смешения для идеальной системы) ![]() . Черта
сверху означает парциальное мольное свойство.
. Черта
сверху означает парциальное мольное свойство.
В литературе можно встретить также понятие «совершенный раствор» - это раствор, идеальный при всех концентрациях. Регулярные растворы состоят из веществ, молекулы которых имеют близкие размеры; атермальные – наоборот, содержат молекулы с резко различающимися размерами (например, растворы полимерных молекул и т.д.).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.