Построение фазовых диаграмм двухкомпонентных жидких растворов предполагает нахождение кривых фазового равновесия жидкость – пар. Для описания фазовых диаграмм температура – состав и давление – состав двухкомпонентных жидких растворов удобно использовать формулу (8.34), которая в явной форме включает в себя коэффициенты активности. Как и ранее, будем считать, что индекс «β» относится к паровой фазе (п), а «α» - к жидкой (ж). Найдем зависимости Т(х2п) и Т(х2ж) при р = const, а также р(х2п) и р(х2ж) при Т = const.
Из (8.34)
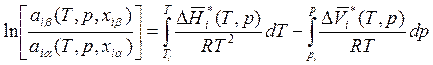 , (9.19)
, (9.19)
тогда при р = const
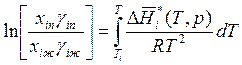 . (9.20)
. (9.20)
Полагая в выражении (9.20) i = 1 или 2, находим
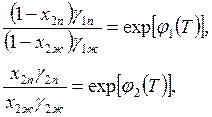 (9.21)
(9.21)
где
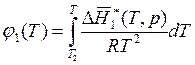 ,
, 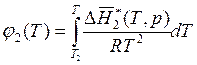 , (9.22)
, (9.22)
а Т1 и Т2 – температуры, при которых давление насыщенных паров над обеими чистыми жидкостями равно заданной величине р.
Если величины γ известны при различных температурах и давлениях, то уравнения (9.21) удобно преобразовать к такой форме:
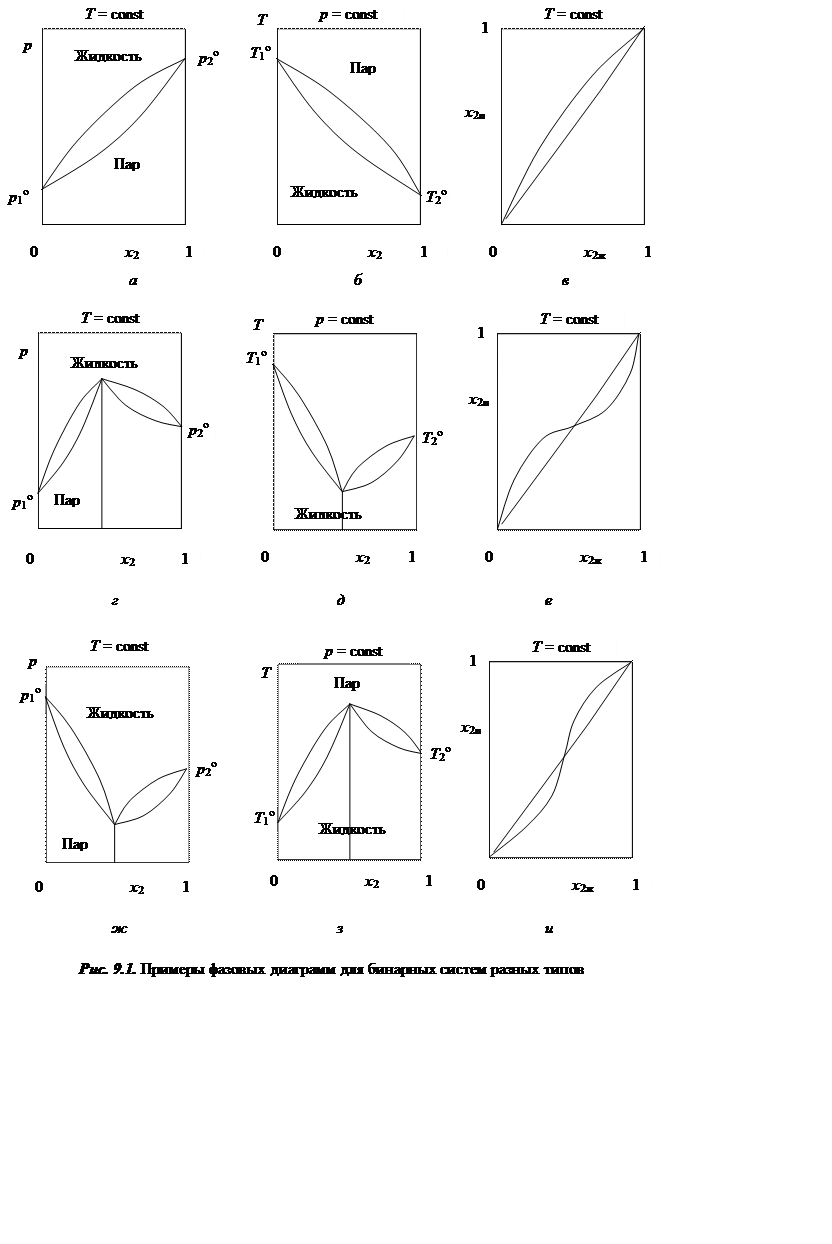
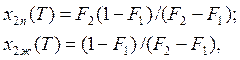 (9.23)
(9.23)
где
![]() ,
, ![]() .
.
Используя уравнения (9.23), можно построить кривые жидкости и пара.
Рассмотрим теперь случай Т = const. Тогда из уравнения (9.19) получим
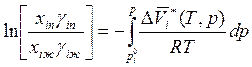 , (9.24)
, (9.24)
где ![]() -
давление паров над i-й чистой жидкостью, а р –
полное давление насыщенных паров над смесью.
-
давление паров над i-й чистой жидкостью, а р –
полное давление насыщенных паров над смесью.
Из выражения (9.24) находим
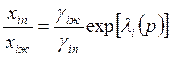 , (9.26)
, (9.26)
где введено обозначение
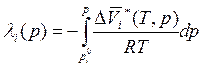 . (9.27)
. (9.27)
Если зависимости γiα и γiβ от Т и р известны, то можно написать следующую систему уравнений:
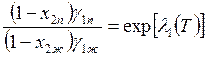 ,
, 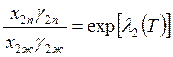 . (9.28)
. (9.28)
Отсюда получаем уравнения для х2п и х2ж:
![]() ,
, ![]() , (9.29)
, (9.29)
где
![]() ,
, ![]() .
.
Если паровая фаза идеальна и молярным объемом жидкой фазы можно пренебречь, то
![]() ,
, ![]() . (9.30)
. (9.30)
Подставляя уравнения (9.30) в выражения (9.29), получаем
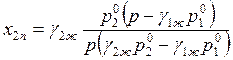 , (9.31)
, (9.31)
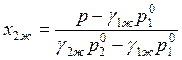 , (9.32)
, (9.32)
Из выражения (9.31) следует уравнений для кривой пара
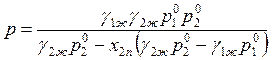 (9.33)
(9.33)
из выражения (9.32) следует уравнение для кривой жидкости
![]() . (9.34)
. (9.34)
Если жидкая фаза также идеальна, то
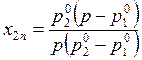 ,
, 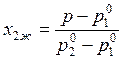 . (9.35)
. (9.35)
Из уравнений (9.35) получаем выражения для кривых пара
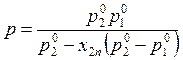 (9.36)
(9.36)
и жидкости
![]() . (9.37)
. (9.37)
Уравнения (9.36) и (9.37) позволяют установить связь между х2п и х2ж при Т = const:
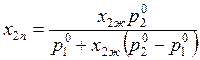 . (9.38)
. (9.38)
Уравнения (9.31 – 9.32) и (9.38) легко получаются и исходя из закона Рауля, записанного в виде выражения (9.3).
Рассмотрим более подробно свойства фазовых диаграмм жидких бинарных растворов, которые могут неограниченно смешиваться при любых молярных соотношениях. В качестве примера на рис. 9.2 приведена диаграмма температура – состав для системы толуол – бензол при фиксированном давлении 53,3*103 Па (400 торр). Кривые фазового равновесия построены по формулам (9.23) в предположении идеальности системы. Эти кривые очень близки к экспериментальным. Видно, что обе кривые образуют фигуру, называемую «линзой» («сигарой» или «рыбкой»).
Если термодинамическое состояние соответствует точке А, расположеной над кривой пара (рис. 9.2), то система находится только в парообразном состоянии. В соответствии с правилом фаз у нее три независимых степени свободы, например, р, Т и х2. Ниже кривой жидкости (точка G) система находится только в жидком состоянии. В этом случае она обладает также тремя степенями свободы.
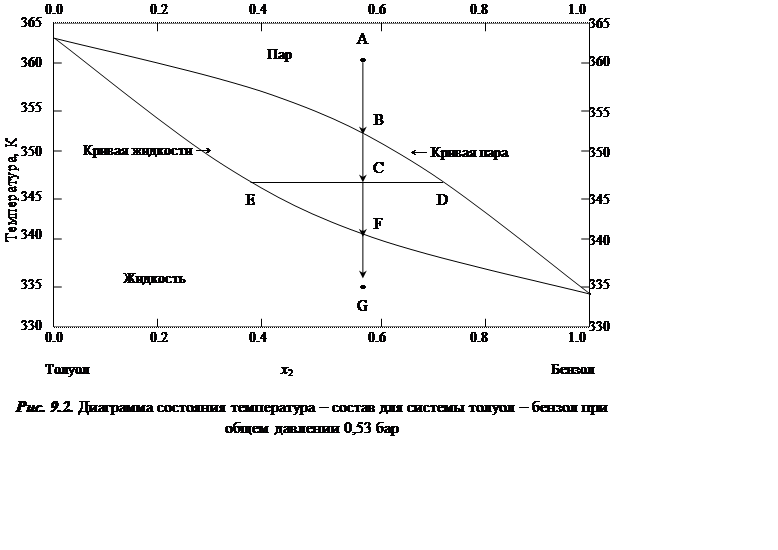
Представляет интерес область, заключенная между кривыми жидкости и пара. Для описания этой области рассмотрим последовательное охлаждение исходной газообразной системы, состояние которой изначально описывается точкой А. По мере охлаждения системы изображающая точка двигается сначала вертикально вниз до пересечения с кривой пара – точка В.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.