9.2. Давление пара над растворами. Закон Рауля
Рассмотрим раствор двух веществ – 1 и 2, находящихся в равновесии с газовой фазой. Равновесие жидкой и газовой фаз определяется равенством химических потенциалов обоих веществ в обеих фазах – жидкой (ж) и паровой (п):
![]() , (i =
1, 2).
, (i =
1, 2).
Поэтому в общем случае неидеального раствора можно записать
![]()
и
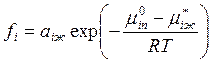 . (9.1)
. (9.1)
Соотношение (9.1) должно выполняться и для чистого i-го компонента, для которого
![]() ,
, ![]() .
.
Это позволяет определить величину
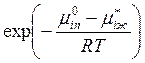 :
:
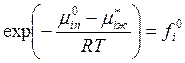 .
.
Следовательно, значение летучести i-го компонента над раствором определяет соотношение
![]() . (9.2)
. (9.2)
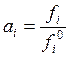
В случае идеальной газовой смеси над раствором:
![]() ,
, ![]() ,
, 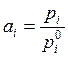
это один из способов определения активности веществ в растворе.
Введя коэффициенты летучести и активности, из (9.2) получаем
![]() , где
, где ![]() и
и ![]() характеризуют коэффициенты летучести и
активности i-го компонента в паровой и в жидкой
фазах соответственно. Отсюда
характеризуют коэффициенты летучести и
активности i-го компонента в паровой и в жидкой
фазах соответственно. Отсюда
![]() .
.
Если газовая фаза идеальна, то
![]()
и
![]() .
.
Если обе фазы идеальны, то
![]() . (9.3)
. (9.3)
Величина ![]() зависит
в принципе от суммарного внешнего давления, но этой зависимостью очень часто
можно пренебречь. Следовательно, в идеальных системах парциальное давление i-го компонента в насыщенном паре над конденсированной
смесью пропорционально его молярной доле в конденсированной фазе. Эта
формулировка определяет закон Рауля. Полное давление равно сумме
парциальных давлений всех компонентов:
зависит
в принципе от суммарного внешнего давления, но этой зависимостью очень часто
можно пренебречь. Следовательно, в идеальных системах парциальное давление i-го компонента в насыщенном паре над конденсированной
смесью пропорционально его молярной доле в конденсированной фазе. Эта
формулировка определяет закон Рауля. Полное давление равно сумме
парциальных давлений всех компонентов:
![]() .
.
Существует и частная формулировка закона Рауля для случая, когда один из компонентов является нелетучим. В этой ситуации полное давление пара в системе определяется только давлением пара растворителя, которое зависит от его молярной доли в соответствии с формулой (9.3). Считая, что молярная доля растворителя в жидкой фазе равна x2, легко можно записать:
![]()
или
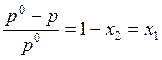 , (9.4)
, (9.4)
где х1 – мольная доля нелетучего компонента в жидкой фазе. Таким образом, относительное уменьшение давления пара над жидкостью равно молярной доле нелетучего компонента. Это – вторая формулировка закона Рауля, имеющая важное, но более частное значение.
Закон Рауля в широком диапазоне концентраций хорошо выполняется только для молекул с близкими структурами, например, смеси бензола и толуола.
9.3. Растворимость газа в жидкости. Закон Генри
Рассмотрим процесс растворения газа в жидкости. В равновесии для растворяющегося компонента выполняется равенство
μ (в газ. фазе) = μ (в жидк. фазе).
Химический потенциал растворяемого газового компонента в рассматриваемых фазах равен
![]() ,
, ![]() , где аi – активность растворенного газа i
в жидкости. Приравнивая химические потенциалы, получаем
, где аi – активность растворенного газа i
в жидкости. Приравнивая химические потенциалы, получаем
![]() . (9.5)
. (9.5)
Отсюда
![]() . (9.6)
. (9.6)
Параметр КГ – называют константой Генри:
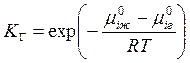 .
.
Выражение (9.6) представляет собой закон Генри.
В идеальной системе концентрация растворенного газа в конденсированной фазе пропорциональна парциальному давлению газа над раствором. Действительно, в этом случае
![]() и
и ![]() .
.
Тогда
![]() , (9.7)
, (9.7)
где хi – молярная доля газа i в жидкости, рi – парциальное давлениерастворенного газа i над жидкостью. Выражение (9.7) применимо и к реальным растворам, но при малых парциальных давлениях растворяющегося газа, когда отличием коэффициента активности от единицы для растворенного газа можно пренебречь.
Зачастую закон Генри записывают также следующим образом:
![]() , (9.8)
, (9.8)
где Сi – концентрация газа i в жидкости, например, в единицах моль/л.
Следует
отметить особенности использования величины ![]() в
формуле (9.5). Коэффициент активности растворенного вещества стремится к
единице при малых концентрациях этого вещества, что позволяет определить
величину
в
формуле (9.5). Коэффициент активности растворенного вещества стремится к
единице при малых концентрациях этого вещества, что позволяет определить
величину ![]() непосредственно из уравнений (9.5) и (9.6)
так:
непосредственно из уравнений (9.5) и (9.6)
так:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.