где α = (1/V)·(∂V/∂T)р , β = (-1/V)·(∂V/∂р)T - коэффициенты термического расширения и сжатия.
Основные термодинамические соотношения для многокомпонентных, гомогенных открытых систем приведены в табл. 5.1.
Таблица 5.1
|
Дифференциальные уравнения |
Интегральные уравнения |
Уравнения Гиббса-Дюгема при Т и p = const |
|
|
|
|
Дополнительные соотношения для химического потенциала
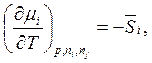
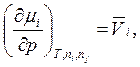
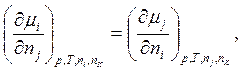
![]()
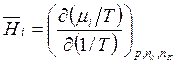 (5.39)
(5.39)
Парциальные свойства можно выразить через мольные функции состояния и мольные доли xi = ni /N , N – общее число молей реакционной смеси.
Например
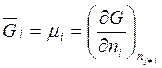 . (5.40)
. (5.40)
Учитывая,
что ![]() (
(![]() – мольная
энергия Гиббса), и производя замену переменных (n1,
n2, ……nj, …nr) → (n, x2, …xr), можно получить
– мольная
энергия Гиббса), и производя замену переменных (n1,
n2, ……nj, …nr) → (n, x2, …xr), можно получить
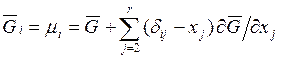 (5.41)
(5.41)
где ![]() символ Кронекера,
символ Кронекера, 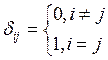 ,
или
,
или 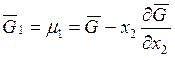 , если система двухкомпонентная.
, если система двухкомпонентная.
Задание.
Выразите ![]() для трехкомпонентного раствора.
для трехкомпонентного раствора.
5.4. Соотношения для химического потенциала
Термодинамические движущие силы и условия равновесия задаются через химические потенциалы в предложении, что известна функциональная зависимость химического потенциала от состава.
Однако, определение таких зависимостей весьма сложная задача.
Понятия летучести и активности тесно связаны с вопросом описания химических потенциалов реальных газов, растворов, сплавов.
5.4.1. Химический потенциал чистого идеального газа
При постоянной
температуре для чистого компонента ![]() (см.
табл.5.1.) и, следовательно,
(см.
табл.5.1.) и, следовательно,
![]() , (5.42)
, (5.42)
где ![]() – мольный объём газа,
– мольный объём газа, ![]() – парциальное
давление газа.
– парциальное
давление газа.
В случае идеального газа
![]() (5.43)
(5.43)
следовательно,
![]() (5.44)
(5.44)
Интегрируя
от ![]() (стандартное
состояние) до
(стандартное
состояние) до ![]() при температуре
Т, получаем
при температуре
Т, получаем
![]() (5.45)
(5.45)
Обычно, р0 = 1 атм, тогда можно записать так
![]() , (5.46)
, (5.46)
где m0(T) – функция только температуры; р – относительное давление, численно равное давлению, измеряемому в атм.
Заметим, что (5.46) и (5.43) эквивалентны.
5.4.2. Химический потенциал чистого реального газа. Летучесть
Уравнения состояния реальных газов сложны. Поэтому, если их использовать вместо (5.43), то соотношения для m получить невозможно в простом виде.
Для описания химических потенциалов реальных газов вводят понятие летучести на основе соотношения [сравните с (5.44)]
![]() (5.47)
(5.47)
где f – летучесть рассматриваемого чистого газа.
Интегрируя от ![]() до p,
при (T = const), будем иметь
до p,
при (T = const), будем иметь
![]() (5.48)
(5.48)
где р0 – стандартное состояние, выбранное так, что f0= 1. В этом случае можно записать
![]() (5.49)
(5.49)
(f – безмерная величина). Стандартным обычно считают идеальный газ р0 = 1атм. Поэтому принимается, что f0 =1 (для идеального газа при р = 1 атм).
Уравнения (5.44), (5.47), (5.46) и (5.49) очень похожи. Если газ идеален, то f = р/(1 атм). При таком подходе проблема описания химического потенциала сводится к проблеме определения зависимости f (р).
В принципе понятие летучести может быть полезно и при описании жидкостей и твёрдых тел, но так как мольный объём жидкости и твёрдого вещества в 1000 раз меньше, чем у газов, то здесь влияние давления на химический потенциал может проявляться только при очень высоких р, поэтому в этом случае использование летучести, как правило, не целесообразно.
5.4.3. Химические потенциалы газовых смесей
При описании смесей обычно оперируют с парциальными величинами (парциальные давление рi, объём Vi и.т.д.).
Например,
![]()
![]()
![]() -
идеальный газ.
-
идеальный газ.
Для смеси газов летучесть вводится аналогично, как это делали для чистого газа, на основе изотермического уравнения
![]() (5.50)
(5.50)
После интегрирования
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.