7.4. Существование двух фаз. Уравнение Клаузиуса-Клапейрона (однокомпонентные системы)
В состоянии равновесия [см. (7.7)]
![]() (см. табл. 3.1) → (7.12)
(см. табл. 3.1) → (7.12)
![]() (7.13)
(7.13)
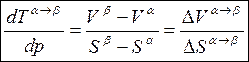 (7.14)
(7.14)
где ![]() – молярные объёмы; Sα, Sβ – молярные
энтропии.
– молярные объёмы; Sα, Sβ – молярные
энтропии.
Это уравнение Клаузиуса-Клапейрона, выражающее зависимость температуры фазового перехода α → β от давления.
При плавлении и
перекристаллизации ![]() , поэтому dT/dр мало, так dT/dр ≈
0,004 К/атм (плавление серебра) – мало.
, поэтому dT/dр мало, так dT/dр ≈
0,004 К/атм (плавление серебра) – мало.
При испарении ![]() на несколько порядков выше, поэтому
dT/dр ≈
28,1 К/атм (вода) –велико.
на несколько порядков выше, поэтому
dT/dр ≈
28,1 К/атм (вода) –велико.
Учитывая, что в
соответствии с (7.11) ![]() (7.14)→
(7.14)→
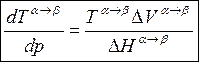 (7.15)
(7.15)
Значения стандартных мольных величин ΔН и ΔS некоторых веществ для процессов плавления и испарения приведены в таблице. Видно, что изменение значений теплоты и энтропии при испарении гораздо больше соответствующих изменений при плавлении.
Таблица 7.1
|
Вещество |
Плавление |
Испарение |
||||
|
Тпл, К |
ΔНпл, кДж/моль |
ΔSпл, Дж/(моль К) |
Тисп, К |
ΔНисп, кДж/моль |
ΔSисп, Дж/(моль К) |
|
|
Ag |
1234 |
11,3 |
9,16 |
2436 |
254 |
104,27 |
|
H2O |
273,2 |
6,01 |
22,00 |
373,2 |
40,66 |
108,96 |
|
SO2 |
197,7 |
7,40 |
37,44 |
263,1 |
24,92 |
94,71 |
|
CH4 |
90,7 |
0,94 |
10,45 |
111,6 |
8,20 |
73,50 |
|
C6H6 |
278,7 |
9,84 |
35,31 |
353,3 |
30,75 |
87,05 |
Для фазовых переходов плавления и испарения существует ряд простых эмпирических закономерностей, позволяющих оценивать энтропию и энтальпию перехода, зная лишь температуру фазового перехода (правило Трутона). Для неполярных жидкостей
![]() , Дж/(моль К)
, Дж/(моль К)
или
![]() , Дж/(моль К).
, Дж/(моль К).
Для простых веществ
![]() , Дж/(моль
К).
, Дж/(моль
К).
Для неорганических веществ
![]() , Дж/(моль
К).
, Дж/(моль
К).
Для органических веществ
![]() , Дж/(моль К).
, Дж/(моль К).
Параметры ΔН и ΔS даже для идеальных систем зависят от температуры и давления. Поэтому уравнение (7.15) нельзя проинтегрировать в явном виде. В связи с этим рассмотрим некоторые частные случаи.
Фазовый переход конденсированное вещество – пар
В случае фазового перехода жидкость-пар вдали от критической точки (относительно низкие давления).
![]() .
.
Следовательно, (7.15)
![]() .
.
В случае идеального газа
![]()
или
![]() .
.
Полагая, что ![]()
![]() . (7.16)
. (7.16)
Здесь Ткип соответствует температуре кипения при р = 1атм. Это константа интегрирования: Т = Ткип при р = 1 атм.
Уравнение (7.16) выражает зависимость давления фазового перехода жидкость/пар от температуры.
Задание. Температура льда открытого катка –2,5 0С. Рассчитать минимальное давление (например, конька), которое необходимо, чтобы расплавить лёд.
Дано. При 0 0С Vж = 1 дм3/кг, Vтв. = 1,09 дм3/кг, теплота плавления ∆Н = 333 кДж/кг.
Указание. Воспользоваться уравнением Клаузиуса-Клапейрона (проинтегрировать от р = 1 атм до р, Т = 270,5 К до 273К).
Фазовый переход конденсированное вещество – конденсированное вещество (без участия газовой фазы)
К процессам такого типа относятся фазовые переходы твердое вещество – твердое вещество, твердое вещество – жидкое вещество, жидкое вещество – жидкое вещество. Примером фазового перехода твердое вещество – твердое вещество могут служить аллотропные превращения одной кристаллической модификации в другую:
S (ромбическая) = S (моноклинная)
Примером фазового перехода твердое вещество – жидкое вещество могут служить процессы плавления.
Для описания таких равновесий используется уравнение Клаузиуса-Клапейрона в форме выражения (7.15). С его помощью можно получить кривую сосуществования двух фаз, если известны зависимости молярных величин ΔН и ΔV от температуры и давления. Если изменения параметров (Т и р) невелики, то можно считать величины ΔН и ΔV постоянными и равными их значениям при стандартных условиях. В этом случае кривая сосуществования двух фаз описывается уравнением
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.