![]() j =1, 2,…, k – 1 (5.51)
j =1, 2,…, k – 1 (5.51)
где xj – мольная доля компонента j; k- число компонентов в смеси.
В данном случае fi – функция р, Т и состава xj , a mi0 – функция только температуры. Эту величину можно определить как химический потенциал компонента i в стандартном состояниипри давлении р0 = 1 атм и составе xi0 =1, т.е. чистый газ i.
Полезно знать, что, так как
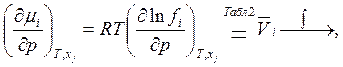 (5.52)
(5.52)
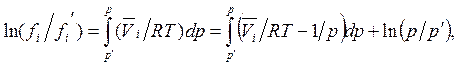 (5.53)
(5.53)
где ![]() -
парциальный мольный объем, р´ - некоторое заданное давление; р –
текущее давление.
-
парциальный мольный объем, р´ - некоторое заданное давление; р –
текущее давление.
Откуда
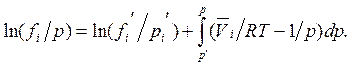 (5.54)
(5.54)
Выбрав р¢ = 0 и учитывая, что (вывод опускаем)
![]() (5.55)
(5.55)
или
![]() (5.56)
(5.56)
можно (5.54) преобразовать к виду
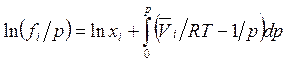 . (5.57)
. (5.57)
или
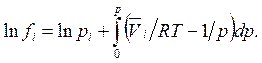 (5.58)
(5.58)
В случае идеального газа член в скобке равен нулю, и, следовательно, fi = рi.
В случае
реальных газов для определения fi необходимы данные о величине ![]() , которую нужно подставлять в (5.57) или
(5.58) во всем интервале интегрирования.
, которую нужно подставлять в (5.57) или
(5.58) во всем интервале интегрирования.
Эту
величину можно определить экспериментально. Для этого надо при фиксированном давлении
и температуре измерить объем смеси газов в зависимости от состава. Затем
аналогичные измерения необходимо повторить при других давлениях, таким образом
можно получить ![]() , что позволит проинтегрировать
(5.57) или (5.58) и получить
, что позволит проинтегрировать
(5.57) или (5.58) и получить ![]() .
.
5.4.4. Идеальный раствор неидеальных газов
Летучесть i – го компонента в идеальном растворе (определение идеального раствора)
![]() (5.59)
(5.59)
где * - чистое вещество; fi* - летучесть чистого компонента; хi – мольная доля i – го компонента.
Для
чистого вещества i соотношение (5.57) можно
переписать в виде (учтя, что для чистого вещества ![]() )
)
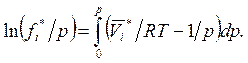 (5.60)
(5.60)
Вычитая (5.60) из (5.57), получим
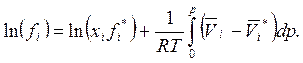 (5.61)
(5.61)
Из (5.61) с учетом (5.59) следует, что
![]() (5.62)
(5.62)
Это соотношение можно рассматривать как еще одно эквивалентное определение идеального раствора.
Соотношение (5.59) позволяет делать оценки летучести газов в смесях по данным летучести для соответствующего чистого газа. Данные по летучести чистых газов в справочниках представлены широко.
5.4.5. Химические потенциалы твёрдых и жидких растворов. Активность
Применение летучести здесь (жидкие и твердые вещества) ограничивается случаями очень высоких давлений, когда изменение давления начинает существенно влиять на химический потенциал.
Активность ai вводится для изучения изменений химического потенциала, связанных с изменением состава раствора при постоянных Т и р.
Активность определяется на основе соотношения
![]() - переменная xi (5.63)
- переменная xi (5.63)
или
![]() (5.64)
(5.64)
mi* отличается от mi0тем, что зависит как от температуры, так и давления. (mi* =mi*(T,p), mi0 = m0(T)).
mi* - химический потенциал компонента i в состоянии сравнения, которое характеризуется тем же составом и структурой, что и в случае mi0,но при переменном давлении р.
Связь aiufi
fi = Гiai , (5.65)
где Гi – коэффициент пропорциональности, определяемый в соответствии с (5.51) и (5.64)
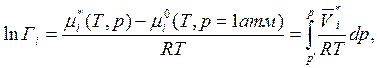 (5.66)
(5.66)
где ![]() - парциальный мольный объём компонента при
составе, отвечающем состоянию сравнивая (оно часто соответствует чистому
элементу i).
- парциальный мольный объём компонента при
составе, отвечающем состоянию сравнивая (оно часто соответствует чистому
элементу i).
При умеренных давлениях влияние р мало, поэтому при малых р
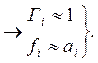 (5.67)
(5.67)
Обычно в качестве состояния сравнения выбирается фазовое состояние, которое стабильно в рассматриваемых условиях.
Различают состояния сравнения по Раулю, по Генри и другие. Состояния сравнения могут быть гипотетическими. Здесь важно лишь зафиксировать это состояние и указать правило, по которому устанавливаются величины, соответствующие состоянию сравнения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.