Согласно Эренфесту
• Фазовый переход первого рода – это равновесный переход вещества из одной фазы в другую, при котором скачком изменяются первые производные от энергии Гиббса G по Т и р (рис. 7.1.).
Следовательно, при фазовом переходе первого рода скачком изменяется S и V, так как
S = -(∂G/∂T)р, V = (∂G/∂р)T.
В системах с фазовым переходом первого рода могут существовать метастабильные состояния. Все обычные фазовые переходы - это первого рода.

• Фазовый переход второго рода – это равновесный переход, при котором скачком изменяются только вторые производные от G (рис. 7.2.).
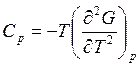 ;
; 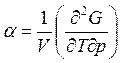 ;
; 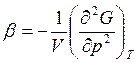 .
.

Здесь G изменяется непрерывно – излома нет. Метастабильные состояния невозможны.
Примеры фазового перехода второго рода – переход жидкого гелия в сверхтекучее состояние, железа из ферромагнитного в парамагнитное состояние, металла из обычного в сверхпроводящее и др.
Рассмотренные законы термодинамики позволяют определять условия существования различных фаз, если система находится в состоянии термодинамического равновесия, или является ли та или иная фаза устойчивой при заданных термодинамических параметрах, например, (р, Т) или других, выбранных для описания системы.
7.2. Стабильность фаз в однокомпонентных системах
При заданных р и Т для анализа устойчивости фаз в качестве функции состояния (характеристической функции) удобно использовать энергию Гиббса (см. раздел 3.2)
![]() . (7.1)
. (7.1)
При р, Т=const было установлено, что условием равновесия системы является
![]() . (7.2)
. (7.2)
Это означает, что при любых заданных р и Т система находится в равновесии, если
![]() . (7.3)
. (7.3)
Отсюда, если при данных Т и р вещество может иметь структуру α или β (образовывать фазу α и β), то α более стабильна, чем β, если
![]() . (7.4)
. (7.4)
При других р и Т условие (7.4) может измениться на противоположное, соответственно, тогда в новых условиях β будет устойчивее α.
Таким образом, для практических расчётов устойчивости необходимо знать зависимость G (р, T) для каждой фазы.
Эту информацию, как правило, можно получить из справочных термодинамических таблиц.
Величину G невозможно определить абсолютно, но этого и не требуется, так как всегда интересует отклонение (изменение) G, поэтому в справочниках обычно даётся величина
G - H2980 (Дж/моль) (G =H - TS).
На рисунке 7.3.
показан пример изменения ![]() от
температуры для цинка. Необходимо обратить внимание, что на этой кривой в точке
фазовых превращений отсутствует разрыв
от
температуры для цинка. Необходимо обратить внимание, что на этой кривой в точке
фазовых превращений отсутствует разрыв
Gтв = Gж,Gж = Gгаз.

Наклон кривой G(T) всегда отрицателен, так как (см. уравнение Максвелла)
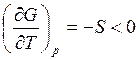 . (7.5)
. (7.5)
Кривая G(T) выгнутая, так как
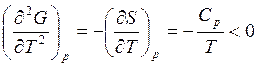 . (7.6)
. (7.6)
Выражение (7.6) получено из (2.6), (3.1) с учетом, что H = U + pV, и следовательно,
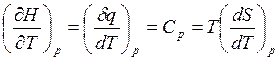 .
.
Интересно отметить другие свойства энергии Гиббса. Так
(∂G/∂р)T = V > 0 – положительный наклон G(р)
(∂2G/∂р2)T= (∂V/∂р)T = -βV < 0 –отрицательная кривизна G(р) (см. рис. 7.4).
На рис. 7.4. показаны зависимости G (T) для алмаза (кривая 1) и графита (кривая 2). Алмаз и графит – это различные фазы углерода. Их отличие состоит в кристаллической структуре.

Из рис. 7.4. следует, что при давлениях р > 20·103 атм из графита можно получить алмаз при комнатной температуре.
7.3. Теплота фазового перехода
В состоянии равновесия при данных (Т, р) должно выполнять условие
![]() (7.7)
(7.7)
или
![]() (7.8)
(7.8)
Следовательно,
![]() (7.9)
(7.9)
или
![]() . (7.10)
. (7.10)
Или
![]() (7.11)
(7.11)
Соотношение
(7.11) позволяет по известному ![]() оценить теплоту
изменения фазового состава
оценить теплоту
изменения фазового состава ![]() (например, плавления,
кипения и т.д.) и наоборот.
(например, плавления,
кипения и т.д.) и наоборот.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.