С учетом (6.36) из (6.15) следует
![]() . (6.37)
. (6.37)
Учтем, что (см. табл. 5.1)
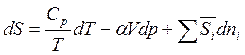 ,
,
![]() , откуда
, откуда
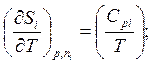
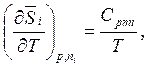 (6.38)
(6.38)
где ![]() - мольная теплоемкость
- мольная теплоемкость
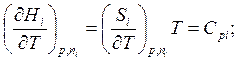
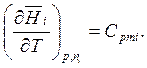 (6.39)
(6.39)
С учетом (6.38), (6.39) из (6.34) получаем
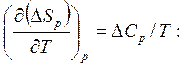
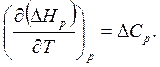 (6.40)
(6.40)
Влияние температуры на Kfможно охарактеризовать производной
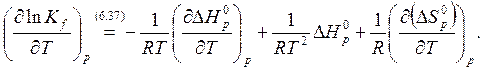 (6.41)
(6.41)
Или с учетом (6.40)
![]()
![]()
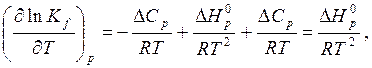
т. е.
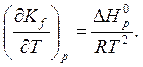 (6.42)
(6.42)
Или
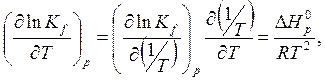 (6.43)
(6.43)
откуда
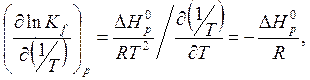 (6.44)
(6.44)
т.е.
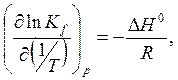 (6.45)
(6.45)
т.е. график lnКf(1/Т) – линейный.
Это уравнение называют уравнением Вант-Гоффа.
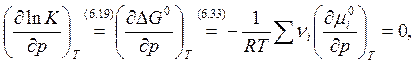 (6.46)
(6.46)
так как ![]() - не зависит от давления (стандартное
состояние р = const).
- не зависит от давления (стандартное
состояние р = const).
Выведенные на основании законов термодинамики зависимости подтверждают установленный ранее экспериментально принцип Ле-Шателье-Брауна.
Принцип Ле-Шателье-Брауна: если система, находящаяся в равновесии, подвергается воздействию, нарушающему равновесие, то реакция протекает в направлении, компенсирующем это воздействие. Например, увеличение давления ускоряет реакцию, которая ведет к уменьшению объема системы. Увеличение температуры ускоряет эндотермическую реакцию. И т.д.
6.3 Гетерогенные химические равновесия
Если в реакции участвует вещество (исходное или продукт), которое находиться в конденсированной фазе, то концентрация этого вещества в газовой фазе при р, Т = const не будет зависеть от того, как протекает реакция, а будет определяться парциальным давлением насыщения рk'', которое зависит от температуры и состава конденсированной фазы.
Если конденсированная фаза – чистое вещество, то рk'' зависит только от температуры. В этом случае, как и в случае гомогенной реакции, можно записать
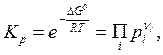
![]() , (6.47)
, (6.47)
где для
вещества, находящегося в конденсированной фазе ![]() постоянно
и не зависит от исходного состава реагентов.
постоянно
и не зависит от исходного состава реагентов.
С другой стороны можно записать, выделив парциальное давление вещества, находящегося в конденсированной фазе.
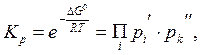
![]() . (6.48)
. (6.48)
Так как 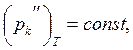 то можно перейти к новой константе
равновесия
то можно перейти к новой константе
равновесия
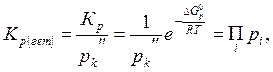
![]() (6.49)
(6.49)
т. е. можно оперировать константой равновесия, для которой правая часть уравнения (6.49) не содержит давления вещества, присутствующего в конденсированной фазе.
Если конденсированное вещество образует раствор, то так поступать нельзя, так как в этом случае рk'' зависит от состава конденсированной фазы.
Примеры:
СаСО3(тв) = СаО(тв)+СО(2)(газ) - производство негашеной извести
![]()
Что нужно сделать, чтобы разложить СаСО3 полностью?
(Продувать! – удалять СО2)
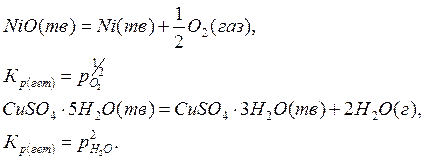
Необходимо
помнить, что константа реакции зависит от того, как определяется ni, поскольку ![]() зависит от величины ni, и от того, как
выбирается стандартное состояние
зависит от величины ni, и от того, как
выбирается стандартное состояние ![]() .
.
6.4. Случай нескольких одновременно протекающих реакций
Если система состоит из некоторого набора веществ и не находится в химическом равновесии, то процесс установления термодинамического равновесия будет сопровождаться химическими реакциями, приводящими к изменению состава системы.
Химические процессы будут протекать таким образом, чтобы внутренняя энергия системы стала минимальной.
При постоянных р и Т dU = dG, поэтому в этих условиях система будет стремиться к достижению минимума энергии Гиббса.
Совокупность минимально возможного числа химических реакций, линейная комбинация которых позволяет записать любую химическую реакцию в системе, называют линейно-независимым набором.
Иными словами, конечный компонентный состав системы должен быть таким (в рамках имеющегося элементного состава), чтобы энергия Гиббса была минимальна. При этом (так как U и G – функции состояния) вопрос о том, за счет каких реакций это произойдет, является неважным. Этот момент необходимо подчеркнуть, так как независимость результатов от пути химического процесса существенно облегчает решение задачи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.