Величина Г2 представляет собой избыток количества растворенного компонента в объеме, включающем поверхность, по сравнению с объемом, содержащим столько же молей растворителя. Если Т и р постоянны, то Г2 зависит только от концентрации растворенного вещества. В этом случае
![]() (в объеме)
(в объеме)![]() .
.
Таким образом, величина адсорбции по Гиббсу равна
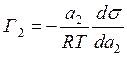 . (12.21)
. (12.21)
Если концентрация растворенного вещества невелика, то ![]() , и, заменяя обозначение С2
на С, находим
, и, заменяя обозначение С2
на С, находим
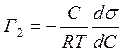 , (12.22)
, (12.22)
где С - концентрация растворенного вещества.
При 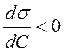 вещества
называют поверхностно-активными (ПАВ), а при
вещества
называют поверхностно-активными (ПАВ), а при 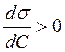 - поверхностно-инактивными. Для ПАВ Г2
> 0 и, следовательно, ПАВ накапливаются в поверхностном слое.
- поверхностно-инактивными. Для ПАВ Г2
> 0 и, следовательно, ПАВ накапливаются в поверхностном слое.
обозначения
А - число Авогадро, энергия Гельмгольца;
ai - активность i –го компонента;
аgi и aki – количество атомов вида g и k соответственно в молекуле i-того вещества;
а(Мп) – активность поверхностных молекул;
а(М) – активность газофазных молекул;
С – теплоёмкость, концентрация;
Сi – концентрация i-го компонента;
СV - теплоёмкость при постоянном объеме;
Cp - теплоёмкость при постоянном давлении;
Сp0 – стандартная теплоёмкость;
![]() - мольная
теплоемкость;
- мольная
теплоемкость;
D - функциональный определитель якобиан;
d – знак полного дифференциала;
Е – эбулиоскопическая постоянная;
F, dF – площадь поверхности, приращение площади поверхности;
f – летучесть;
fi – летучесть i-го компонента в смеси;
fi* - летучесть чистого компонента;
G – энергия Гиббса;
G0 – стандартная энергия Гиббса;
![]() – мольная энергия Гиббса;
– мольная энергия Гиббса;
![]() - парциальная мольная энергия
Гиббса;
- парциальная мольная энергия
Гиббса;
DG0i298 – стандартная энергия Гиббса образования вещества i;
DGT0 - изменение энергии Гиббса системы в результате реакции в стандартных условиях;
DG = ¶G/¶nb -движущая сила;
H – энтальпия;
Н0 - стандартная энтальпия;
H0i – стандартная энтальпия i –го вещества ;
![]() - энтальпия при p = 1 атм и Т = 298К
- энтальпия при p = 1 атм и Т = 298К
Нf - теплота образования вещества;
H0fi – стандартная энтальпия образования i-го вещества;
![]() - парциальная мольная энтальпия i-го вещества;
- парциальная мольная энтальпия i-го вещества;
ΔН (или ΔН0) – теплота реакции или тепловой эффект реакции (теплота, выделяющаяся в результате реакции νi молей вещества; νi – стехиометрический коэффициент; ΔH > 0 – реакция эндотермическая, ΔН < 0 – реакция экзотермическая);
ΔHсг - теплота сгорания;
![]() - изменение энтальпии в
результате фазового перехода (плавления);
- изменение энтальпии в
результате фазового перехода (плавления);
DHT0 - тепловой эффект реакции при темппературе Т;
Кf - константа химического равновесия, выраженнаяя через летучесть;
Кa - константа равновесия, выраженнаяя через активность;
Кр - константа равновесия, выраженнаяя через парциальное давление;
КC - константа равновесия, выраженнаяя через концентрации;
Кx - константа равновесия, выраженнаяя через мольные доли;
Кр,j – константа равновесия реакции j;
КГ –константа Генри;
К - константа равновесия адсорбции;
кдес - коэффициент, характеризующий скорость десорбции;
кадс - коэффициент, характеризующий скорость адсорбции;
Кi - константа равновесия процесса образования i-го кластера
m – число компонентов, моляльность;
М – молекулярная масса молекул растворителя;
Мi – кластер, состоящий из i-молекул;
N- число молекул, центров;
NП - полное число мест на поверхности;
Nдес - число молекул, улетающих в единицу времени с поверхности;
Nадс - число молекул, адсорбирующихся на поверхности;
n - число молей;
ni – число молей i- го вещества;
nβ – число молей вещества в фазе β;
n1n, n2n, … nmn - содержание компонентов 1 ... m в фазе n;
![]() –давление
;
–давление
;
рi – парциальное давление;
р0 – стандартное давление, выбранное так, что f0 = 1;
![]() - давление паров i-го вещества над чистой жидкостью этого вещества;
- давление паров i-го вещества над чистой жидкостью этого вещества;
р´ - некоторое заданное давление;
р'' - давление насыщения;
рк – критическое давление системы;
q – теплота;
R –газовая постоянная (R = 8,31451 Дж/(моль·К));
r – радиус;
S – энтропия;
Si – мольная энтропия i-го вещества;
Sf - энтропия образования вещества;
![]() - парциальная мольная энтропия;
- парциальная мольная энтропия;
![]() - энтропия чистого вещества;
- энтропия чистого вещества;
DS0 - изменение энтропии системы в результате реакции в стандартных условиях;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.