Если раствор близок к идеальному, то
для разности ![]() можно написать
можно написать
![]() , (11.2)
, (11.2)
где х1 – молярная доля растворенного вещества.
Теперь можно поставить вопрос, а какое давление р следует приложить к раствору, чтобы химический потенциал растворителя в растворе стал бы равен химическому потенциалу чистого растворителя? Изменение μ под влиянием давления определяется в соответствии с (5.39) величиной
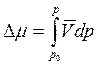 , где
, где ![]() -
парциальный молярный объем растворителя. Считая, что
-
парциальный молярный объем растворителя. Считая, что ![]() не
зависит от р, получаем
не
зависит от р, получаем
![]() , (11.3)
, (11.3)
где π – осмотическое давление, равное
![]() .
.
Приравнивая выражения (11.2) и (11.3), находим
![]()
или
![]() , (11.4)
, (11.4)
где С – концентрация растворенного вещества. Осмотическое давление, как это следует из последней формулы, численно равно тому давлению, которое производил бы идеальный газ, взятый в концентрации С растворенного вещества.
Измерение осмотического давления можно произвести с помощью полунепроницаемых мембран, пропускающих только растворитель. В этом случае растворитель диффундирует сквозь мембрану в раствор до тех пор, пока давление жидкости в сосуде с раствором не скомпенсирует разность химических потенциалов.
Следует отметить, что формула (11.3) не очень точна. Лучшие результаты дает другая формула. Учитывая выражение (11.1), для химического потенциала растворителя в растворе можно записать
![]() . (11.5)
. (11.5)
Если давление р таково,
что ![]() , то из уравнения (11.5) получим
, то из уравнения (11.5) получим
![]() . (11.6)
. (11.6)
Величину а можно
рассчитать, если известно давление пара растворителя над раствором. Так как в
соответствии с (9.2) 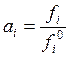 , а в случае идеальной газовой
фазы
, а в случае идеальной газовой
фазы 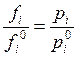 , тогда
, тогда
![]() , (11.7)
, (11.7)
где р – давление паров растворителя над раствором, а р0 – давление над чистым растворителем. Формула (11.7) гораздо точнее описывает данные по осмотическому давлению. Таким образом, величина осмотического давления прямо связана с величиной активности растворителя.
12. адсорбция
Любая поверхностьспособна захватить (адсорбировать) молекулы из газовой или жидкой фазы. Адсорбцией называют явление образования поверхностного слоя с повышенной концентрацией газа или растворенного вещества на границе раздела с твердым телом или иной конденсированной фазой. Твердое тело при этом называют адсорбентом, а адсорбируемое вещество – адсорбатом. Явление удаления адсорбированного вещества с поверхности называют десорбцией.
Различают физическую адсорбцию, происходящую за счет дисперсионных (ван-дер-ваальсовских) взаимодействий молекул адсорбата с адсорбентом, образования водородных связей и т.п., и химическую адсорбцию (хемосорбцию), происходящую за счет образования химических связей между адсорбатом и адсорбентом. Для физической адсорбции характерны величины теплоты адсорбции ~ 2-5 кДж/моль, для химической адсорбции значения теплот обычно превышают 10 кДж/моль. Химическая адсорбция может сопровождаться диссоциацией молекул адсорбата и другими его химическими превращениями.
Специально приготовленные адсорбенты (например, силикагели, оксиды алюминия, активированные угли) могут иметь огромную удельную поверхность, измеряемую сотнями и даже тысячами м2 на грамм адсорбента.
12.1. Изотерма адсорбции Генри
В простейшем случае равновесие между молекулами в газе (М) и молекулами на поверхности (Мп) можно записать как химическую реакцию:
М = Мп.
Константа равновесия записывается обычным образом:
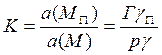 , где а(Мп)
– активность поверхностных молекул; а(М) – активность (летучесть)
газофазных молекул; Г – концентрация адсорбированных молекул; р и
γ – давление и коэффициент летучести молекул, выраженный в единицах моль/м2
или (моль/см2); γп – коэффициент активности поверхностных
молекул, в газовой фазе.
, где а(Мп)
– активность поверхностных молекул; а(М) – активность (летучесть)
газофазных молекул; Г – концентрация адсорбированных молекул; р и
γ – давление и коэффициент летучести молекул, выраженный в единицах моль/м2
или (моль/см2); γп – коэффициент активности поверхностных
молекул, в газовой фазе.
Если адсорбированные молекулы заполняют малую долю поверхности, то можно считать γп ≈ 1. Если давления невелики, то можно положить: γ ≈ 1. Тогда для величины Г получим
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.