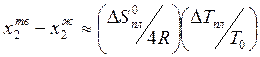 . (10.25)
. (10.25)
Это соотношение
можно использовать для экспериментальной проверки, насколько система (раствор)
близок к идеальной: экспериментально измеряется ![]() и
сравнивается с расчетом по (10.25).
и
сравнивается с расчетом по (10.25).
Из (10.25)
видно, что ширина ![]() пропорциональна энтропии
плавления и разности температур плавления чистых веществ.
пропорциональна энтропии
плавления и разности температур плавления чистых веществ.
10.5. Фазовые диаграммы сложных видов
Пример,
рассмотренный на рисунке 10.5, соответствует достаточно простой фазовой
диаграмме. Это связано с тем, что кривые ![]() и
и ![]() с увеличением температуры остаются
простыми: имеют по одному экстремуму, вогнуты в одну сторону, пересекаются при
любой T не более чем в одной точке и т.д.
с увеличением температуры остаются
простыми: имеют по одному экстремуму, вогнуты в одну сторону, пересекаются при
любой T не более чем в одной точке и т.д.
В более сложных
случаях кривые ![]() и
и ![]() с
изменением температуры могут деформироваться и пересекаться произвольным
образом. В этом случае фазовые диаграммы могут иметь весьма сложный вид. Число
фаз может быть максимальным. Могут существовать такие условия, при которых
одновременно могут существовать и жидкая фаза и несколько твердых одновременно.
Линии солидуса и ликвидуса могут иметь максимумы или минимумы.
с
изменением температуры могут деформироваться и пересекаться произвольным
образом. В этом случае фазовые диаграммы могут иметь весьма сложный вид. Число
фаз может быть максимальным. Могут существовать такие условия, при которых
одновременно могут существовать и жидкая фаза и несколько твердых одновременно.
Линии солидуса и ликвидуса могут иметь максимумы или минимумы.
Вид кривых ![]() может быть таким, что можно провести общую
касательную к двум точкам
может быть таким, что можно провести общую
касательную к двум точкам ![]() и одной
и одной ![]() одновременно (рис.10.6, а).
одновременно (рис.10.6, а).
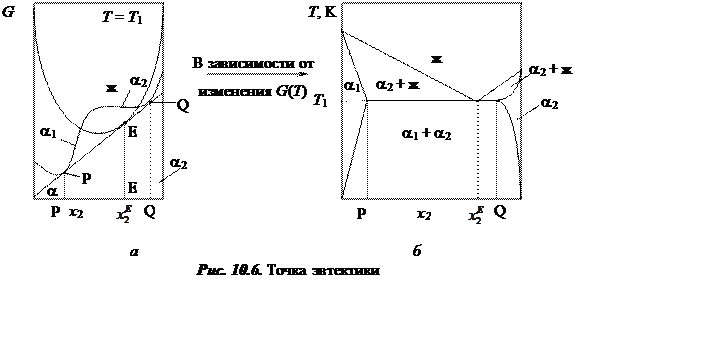
На рисунке 10.6
это точки P, Е, Q.
Точка Е соответствует условиям одновременного существования жидкой фазы, ![]()
![]() и
и ![]() . Такая точка называется точкой эвтектики,
а соответствующая температура - эвтектической. Это наиболее низкая температура,
при которой сплав 1 - 2 еще полностью или частично жидкий.
. Такая точка называется точкой эвтектики,
а соответствующая температура - эвтектической. Это наиболее низкая температура,
при которой сплав 1 - 2 еще полностью или частично жидкий.
Состав ![]() - эвтектический состав.
- эвтектический состав.
Эвтектическая
точка характеризуется тем, что существует касательная, общая к кривым ![]() и двум кривым
и двум кривым ![]() и
и ![]() , соответствующим двум твердым фазам. Причем
точка касания к
, соответствующим двум твердым фазам. Причем
точка касания к ![]() лежит между точками касания
(равновесия) твердых растворов.
лежит между точками касания
(равновесия) твердых растворов.
Перетектические
точки. Подобная ситуация может возникнуть и в другом случае (рис. 10.7),
при котором также возможно провести касательную к трем точкам ![]() ,
, ![]() и
и ![]() , но точка касания (равновесия) для
жидкости не лежит между точками касания (равновесия) для твердых растворов.
Такая точка называется перетектической.
, но точка касания (равновесия) для
жидкости не лежит между точками касания (равновесия) для твердых растворов.
Такая точка называется перетектической.
Если вместо
жидкой фазы в подобной ситуации выступает какая-то другая твердая фаза ![]() , то точку Р называют перетектоидной.
, то точку Р называют перетектоидной.
10.6. Расчет фазовых диаграмм
Расчет фазовых диаграмм сводится к расчету фазовых границ и равновесия между двумя фазами.
При равновесной
температуре Т равновесные составы ![]() и
и ![]() двух фаз aи b выражаются уравнениями
(8.7). Учитывая, что
двух фаз aи b выражаются уравнениями
(8.7). Учитывая, что
![]() ,
, ![]() , (
, (![]() , Т, р
, Т, р ![]() )
) ![]()
![]()
![]() , где g - коэффициент активности, уравнения (8.7) можно переписать в
виде:
, где g - коэффициент активности, уравнения (8.7) можно переписать в
виде:
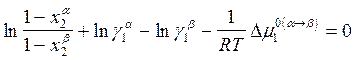 , (10.26)
, (10.26)
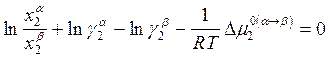 , (10.27)
, (10.27)
где ![]() -
разность значений химического потенциала i в
двух структурах a и b при давлении р = 1атм
(стандартное состояние по Раулю: р = 1атм,
-
разность значений химического потенциала i в
двух структурах a и b при давлении р = 1атм
(стандартное состояние по Раулю: р = 1атм, ![]() ).
).
Логарифмический
коэффициент активности ![]() обычно можно выразить через молярные
доли x2 полиномами.
обычно можно выразить через молярные
доли x2 полиномами.
В этом случае
система уравнений (10.26 - 10.27) может быть решена относительно ![]() и
и ![]() . Обычно
решения находят численными методами, основанными на технике итераций, и другими
методами.
. Обычно
решения находят численными методами, основанными на технике итераций, и другими
методами.
Иногда возникает необходимость по известным экспериментально определенным фазовым диаграммам определить термодинамические параметры (свойства). Эта задача решается как обратная к предыдущей. Методы решения применяются разные в зависимости от сложности системы.
11. осмотическое давление.
Явление осмоса заключается в диффузии молекул растворителя через полунепроницаемые мембраны, пропускающие только растворитель и разделяющие чистый растворитель и раствор (или растворы с различной концентрацией). Рассмотрим систему, состоящую из чистого растворителя и раствора, разделенных полунепроницаемой мембраной. Химический потенциал растворителя в растворе равен
![]() , (11.1)
, (11.1)
где ![]() - химический потенциал в состоянии
сравнения. Пусть состояние сравнения соответствует чистому веществу. Для
остальных величин отношение к чистому веществу показывается индексом «0». Из
(11.1)
- химический потенциал в состоянии
сравнения. Пусть состояние сравнения соответствует чистому веществу. Для
остальных величин отношение к чистому веществу показывается индексом «0». Из
(11.1)
![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.