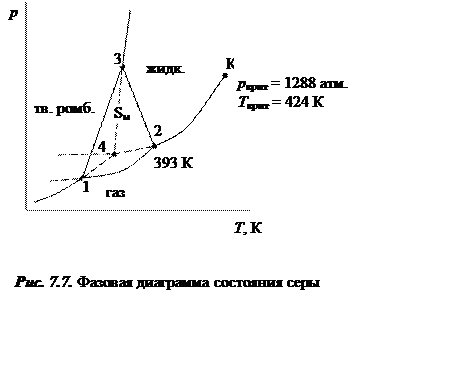
При этом в действительности возможна и четвертая «тройная» точка «4» метастабильного сосуществования ромбической модификации с жидкой и твердой фазами.
Как и в случае фазовой диаграммы для воды, кривая равновесия жидкая сера – газообразная сера обрывается в критической точке.
7.7. Критическое состояние вещества
Нагревание жидкости, находящейся в равновесии с паром, при некоторых довольно строгих условиях, накладываемых на температуру, давление и объем системы может приводить к внезапному исчезновению границы между жидкой и газовой фазой. Состояние вещества (или смеси веществ), возникающее при исчезновении различия между фазами, находящимися в равновесии друг с другом (например, между жидкостью и ее паром, между двумя жидкостями и др.), называют критическим состоянием. На фазовой диаграмме в этой точке кривая сосуществования жидкости и пара обрывается. Точка на термодинамической диаграмме, соответствующая критическому состоянию вещества, называется критической точкой (точка К на рис. 7.8). Критические состояния вещества свойственны не только системам с равновесием типа жидкость – ее насыщенный пар, но иногда также системам с равновесием несмешивающихся жидкостей и даже аморфных или кристаллических твердых фаз.
Параметры системы в критическом состоянии (рк, Тк, Vк, состав хк и т.п.) называют критическими параметрами. За пределами критического состояния в «сверхкритическом» состоянии, т.е. в случае равновесия жидкость – пар, при более высоких температуре и/или давлении, чем Тк и рк, сосуществование рассматриваемых фаз невозможно и система превращается в однофазную (гомогенную). В этом смысле критическое состояние является предельным случаем двухфазного равновесия.
В критическом состоянии поверхностное межфазное натяжение на границе раздела сосуществующих фаз равно нулю. Поэтому вблизи этого состояния могут наблюдаться большие флуктуации плотности вещества и самопроизвольно образующиеся и термодинамически стабильные высокодисперсные структуры – аэрозоли, пены, эмульсии. Это легко детектируется экспериментально и придает большие особенности данной области существования вещества: для нее характерны наличие опалесценции, замедление установления теплового равновесия, изменение характера броуновского движения, аномалии вязкости, теплопроводности и т.п.
При приближении к критическому состоянию термодинамические свойства сосуществующих в равновесии фаз (плотность, теплоемкость и др.) изменяются постепенно, без скачка. Именно поэтому критическое состояние наблюдается лишь при равновесии изотропных фаз (аморфных, жидких и/или газообразных) или кристаллических фаз с одним типом решетки.
Из простого анализа изотермы системы газ – жидкость (рис. 7.8.) видно, что в критическом состоянии давление в системе не изменяется при изотермическом изменении объема. Действительно, для температуры Тк особенности состояния вещества в точке «К» на рис. 7.8 описываются уравнениями (см. п. 3.1)
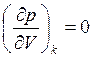 ,
, 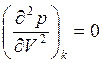 . (7.18)
. (7.18)

Данные уравнения называются уравнениями критического состояния вещества и позволяют связывать критические параметры с параметрами уравнений, например неидеальных газов. Таким образом, этому состоянию соответствует бесконечно высокая сжимаемость вещества, как и в фазовых переходах первого рода. Поэтому очевидно, что при обходе критической точки со стороны температур и давлений, превышающих Tк и рк, у веществ должен наблюдаться максимум изотермической сжимаемости:
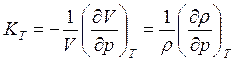 . (7.19)
. (7.19)
Очевидно также, что при таком «обходе» критической точки из области существования одной фазы к области существования другой теплота осуществленного «фазового» перехода равна нулю: ΔН = 0. Это, а также высокую, по сравнению с жидкостью, подвижность «сверхкритической фазы» и отсутствие в ней капиллярных явлений с успехом используют в промышленности для реализации многих трудоемких и энергоемких процессов экстракций, синтеза высокопористых материалов и т.п. Примером такой технологии является получение растворимого кофе путем его экстракции из зерен в сверхкритическом СО2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.