откуда
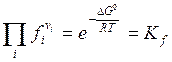 . (6.15)
. (6.15)
Величина Kf является функцией только температуры, зависит от выбора стандартных состояний и не зависит от фактического состава системы. Кf называется константой химического равновесия.
Для многих реакций Кf представлены в справочниках в виде табличных значений от температуры. Соотношение (6.15) в виде
![]() (6.16)
(6.16)
известно, как
закон действия масс. (Необходимо помнить, что здесь ![]() < 0
– для реагентов и
< 0
– для реагентов и ![]() > 0 для продуктов).
> 0 для продуктов).
Пусть
i = 1, 2,…, k соответствуют продуктам
(![]() > 0),
> 0),
i = k + 1,…, r соответствуют реагентам
(![]() > 0), тогда (5.57) ®
> 0), тогда (5.57) ®
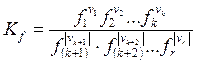 . (6.17)
. (6.17)
Если давления не велики и газ можно считать идеальным, fi » рi ,то в этом случае вместо (6.15) можно записать
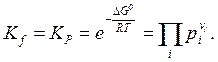 (6.18)
(6.18)
Константы равновесия (из соображения удобства) могут записываться различным образом: через летучести (Кf), через активности Кa, через парциальные давления Кр, через концентрации (КC) или мольные доли Кx. Соотношения между этими величинами зависят от соотношений между различными единицами измерений и от вида соотношений, связывающих летучести, активности, давления и концентрации между собой.
Оперируя понятием активности [см.(6.9)], совершенно аналогично можно получить
![]() . (6.19)
. (6.19)
Ка зависит от выбора стандартного состояния (или состояния сравнения). Здесь DG*¹ DG0в общем случае и, следовательно,
Кf ¹ Кa.
В терминах активности закон действия масс можно записать в виде
![]() (6.20)
(6.20)
Если допустима замена ai = xi (для идеальных жидких и твёрдых растворов), то
![]() (6.21)
(6.21)
Если в справочных данных сведения о константах равновесия отсутствуют, то значения констант равновесия могут быть вычислены на основе других термодинамический данных для рассматриваемых индивидуальных веществ с использованием соотношений типа (6.19), (6.18), (6.15).
При
этом необходимы данные для определения ![]() или
или ![]() :
:
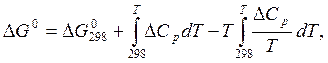 (6.22)
(6.22)
где ![]() (ni < 0 – реагенты,
ni
> 0 – продукты)
(ni < 0 – реагенты,
ni
> 0 – продукты)
![]() (6.23)
(6.23)
DG0i298 – свободная энергия Гиббса образования вещества i.
Кроме того, полезно соотношение
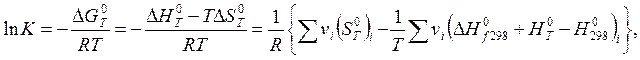 (6.24)
(6.24)
где DGT0, DHT0,DST0 – изменение энергии Гиббса, энтальпии (тепловой эффект реакции) и энтропии системы в результате реакции; (DH0f298)iи (H0298)i – тепловой эффект реакции и теплота образования компонента i из элементов при стандартной температуре; (HT0– H2980)i, (ST0)i – энтальпия и энтропия при соответствующей температуре.
6.2 Влияние температуры и давления на константу равновесия
Для любой реакции S Аivi=0, не находящейся в равновесии, при p, Т = const
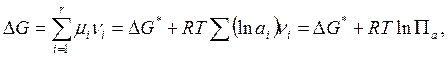 (6.25)
(6.25)
где ![]()
Учитывая, что
![]() [см (6.15), (6.18)],
[см (6.15), (6.18)],
![]() (6.26)
(6.26)
Это уравнение изотермы химической реакции.
Аналогично можно получить
![]() (6.27)
(6.27)
И, если газ идеальный, т.е. fi=pi
![]() (6.28)
(6.28)
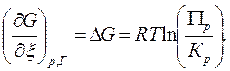 (6.29)
(6.29)
Направление реакции
Прямая реакция будет идти самопроизвольно, если DG < 0, т.е.
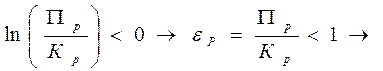
![]() . (6.30)
. (6.30)
Прямая реакция
В противном случае, имеет место обратная реакция (рис. 6.2)
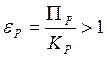
![]() (6.31)
(6.31)
Обратная реакция

Изобара реакции (влияние температуры)
В соответствии с определением
G = H – TS
Следовательно,
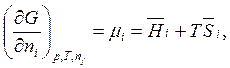 (6.32)
(6.32)
где ![]() - парциальные мольные энальпии и энтропии.
- парциальные мольные энальпии и энтропии.
![]() . (6.33)
. (6.33)
И, так как
![]() (энтальпия
реакции), (6.34)
(энтальпия
реакции), (6.34)
![]() (энтропия реакции), то
(энтропия реакции), то
![]() . (6.35)
. (6.35)
Для стандартного состояния аналогично
![]() . (6.36)
. (6.36)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.