Из (8.7) с учетом (5.41) и того, что для бинарной системы
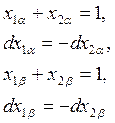
следует
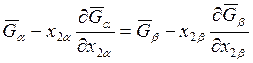 ,
,
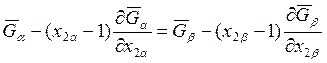 . (8.9)
. (8.9)
Вычитая из второго уравнения первое, получаем
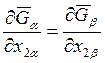 . (8.10)
. (8.10)
При выводе соотношения (8.10)
предполагалось, что зависимости молярных энергий Гиббса ![]() и
и
![]() от состава определяются только величинами х2a и х2b соответственно. Если вместо х2a и х2b использовать х1a и х1b, то аналогичное уравнение будет иметь
вид
от состава определяются только величинами х2a и х2b соответственно. Если вместо х2a и х2b использовать х1a и х1b, то аналогичное уравнение будет иметь
вид
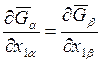 . (8.11)
. (8.11)
Уравнения (8.10) и (8.11) можно записать и без указания конкретного компонента в форме
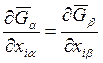 , (i = 1, 2). (8.12)
, (i = 1, 2). (8.12)
Перейдем к рассмотрению дифференциальных уравнений (8.8). Для dμ1α можно записать
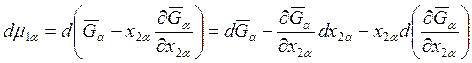 .
.
Учитывая, что
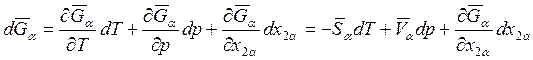 , для dμ1α получаем:
, для dμ1α получаем:
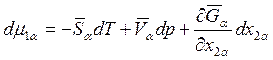 .
.
Для dμ1β можно записать аналогичное выражение
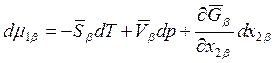 .
.
Приравняв теперь dμ1α и dμ1β и учитывая соотношение (8.11), находим
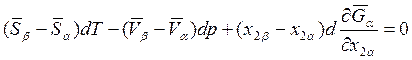 (8.13)
(8.13)
или
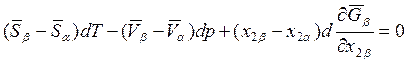 . (8.14)
. (8.14)
Аналогичные выражения можно
записать, заменив х2a
и х2b на х1a и х1b соответственно. Раскрывая выражение
для 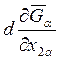 , находим
, находим
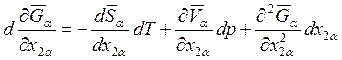 .
.
Подставляя последнее выражение в (8.13), получаем
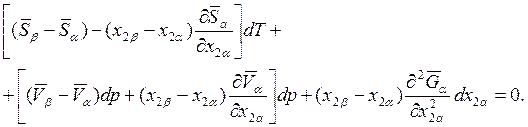 (8.15)
(8.15)
Следует отметить, что в уравнении
(8.15) величину ![]() можно заменить на
можно заменить на ![]() , хia на хib соответственно и записать его в
следующей общей форме:
, хia на хib соответственно и записать его в
следующей общей форме:
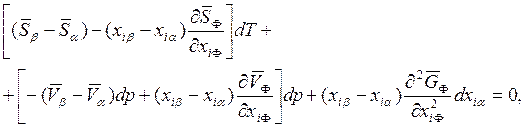 (8.16)
(8.16)
где i = 1 или 2, а Φ = α или β. Уравнение (8.16) является наиболее общим уравнением, описывающим термодинамику двухфазных, двухкомпонентных систем. Оно носит название уравнение Ван дер Ваальса. Отметим, что в этом уравнении используются только молярные величины, относящиеся к одному молю фазы α или β.
На практике зачастую применяют несколько иные выражения для описания двухфазных, двухкомпонентных систем, в которых используются как молярные, так и парциальные молярные величины. Из уравнений (8.8)
![]()
получаем:
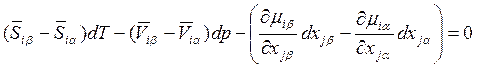 , (8.17)
, (8.17)
где i, j = 1 или 2, i ≠ j. Так как в равновесии
![]() , то для величины
, то для величины ![]() можно записать
можно записать
![]() , где
, где ![]() .
.
Для определенности предположим, что в уравнении (8.17) j = 2. Тогда
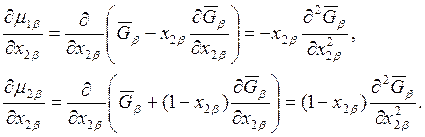 (8.18)
(8.18)
Аналогично
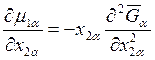 ,
, 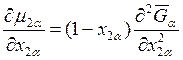 . (8.19)
. (8.19)
Подставляя уравнения (8.18) и (8.19) в выражение (8.17), получаем следующие два уравнения:
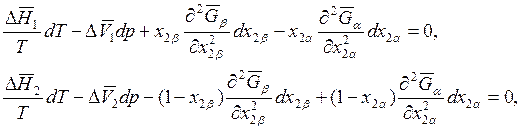 (8.20)
(8.20)
где ![]() .
.
Уравнения (8.20) широко используются при описании двухфазных, двухкомпонентных систем. Из вывода уравнений (8.16) и (8.20) следует эквивалентность.
8.5. Уравнения фазового равновесия двухфазных двухкомпонентных систем
Под уравнением фазового равновесия будем понимать зависимость какого-либо одного термодинамического параметра от другого при постоянном значении третьего. Их удобно получать из общих уравнений (8.20). Уравнения (8.20) содержат четыре параметра, но из этих двух уравнений всегда можно исключить один термодинамический параметр и получить одно уравнение с тремя параметрами, из которых только две величины являются независимыми в полном соответствии с правилом фаз.
Рассмотрим сначала уравнения фазового равновесия при постоянстве состава одной из фаз, например α – фазы. Если х2a = const и, следовательно, dх2a = 0, то уравнения (8.20) будут иметь вид
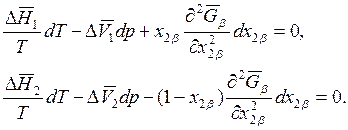
Выражая из первого уравнения 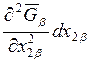 и подставляя во второе, для величины
и подставляя во второе, для величины 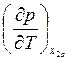 находим
находим
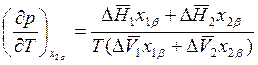 . (8.21)
. (8.21)
В этом уравнении величины х1b и х2b могут зависеть от температуры наряду
с ![]() и
и ![]() .
Выражение для величины
.
Выражение для величины 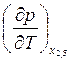 легко получается из
(8.21) заменой индекса β на α. Уравнение (8.21) можно записать в более
компактной форме:
легко получается из
(8.21) заменой индекса β на α. Уравнение (8.21) можно записать в более
компактной форме:
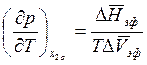 , (8.22)
, (8.22)
где
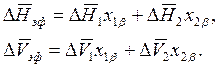
Для конкретности здесь и в дальнейшем условимся индекс «β» приписывать фазе с более высоким значением молярной энтропии. Например, если рассматривается равновесие между жидкостью и паром, то паровой фазе соотнесем индекс «β».
Аналогичным образом при х2α = const находим
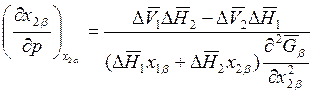 ; (8.23)
; (8.23)
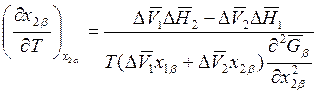 . (8.24)
. (8.24)
Если T = const, то
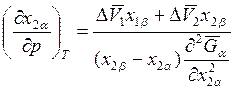 ; (8.25)
; (8.25)
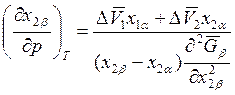 ; (8.26)
; (8.26)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.