Для никкелирования берут 70 г двойной сернокислой соли ник-' келя и аммония на 1 л воды и к этому раствору прибавляют 25 г< сернистого аммония и 5 г лимонной кислоты.
Во всех случаях берут анод, состоящий из того металла, слоем которого желают покрыть предмет; так, при никкелировашш применяют анод из никкеля, "а при серебрении анодом служит серебряная-пластинка.
Однако, необходимо заметить, что предметы, подвергаемые позолоте,-серебрению или никкелиррванию, нужно самым тщательным образом очистить от покрывающего их жирного слоя. Поэтому все предметы прежде всего погружают в раствор соды, потом их тщательно промывают, энергично трут щеткой, а затем погружают в специальные кислые
 ванны, называемые протравами. Затем их снова моют и только
после такой
тщательной чистки погружают в электролит.
ванны, называемые протравами. Затем их снова моют и только
после такой
тщательной чистки погружают в электролит.
При пропускании через ванну электрического тока необходимо обращать внимание на то, чтобы на каждый квадратный дециметр поверхности, которую желают нивке-лировать, приходилось но более 0,5 — 0,8 ампера.
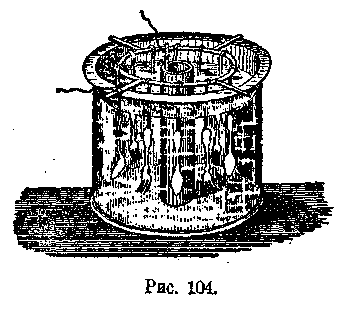
На рис. 104 изображена ванна для гальванического серебрения: все покрываемые серебром предметы (вилки, ложки и пр.) подвешены на металлических крючках и соединены друг с другом общим подвесным кольцом, которое соединяется с минусом батареи. В середине ванны помещен анод из серебра, который отдельным проводником соединяется с положительным полюсом батареи.
§ 49. Электрическое рафинирование (очистка) металлов.
Если взять раствор медного купороса и погрузить в него медные электроды, причем анодная пластинка может состоять из невполне чистой меди, то при пропускании, через этот раствор электрического тока анод будет растворяться, и химически чистая, так называемая электролитическая медь будет осаждаться на катоде, а все остальные примеси будут падать на дно ванны в виде грязного осадка.
Подобным же образом производится очистка рафинирование) и других металлов. Так, например, из хлористой соли натрия и алюминия получают чистый алюминий; подобным же образом добываются кальций и магний.
§ 50. Электрические аккумуляторы.
Электрическим
аккумулятором называется такой прибор, который
можно зарядить электрическим током,'т.' е. в котором можно запасти некоторое
количество электрической энергии, с тем чтобы тот же прибор .можно было
поставить на разрядку и он служил источником электрической энергии. ^
Действие электрического аккумулятора основано на явлении поляризации электродов рассмотренном нами на стр. 48. Мы видели, что электродвижущая сила поляризации создает во внешней цепи так называемый вторичный ток, который может существовать в цепи до тех пор, пока электроды остаются поляризованными, т. е. покрыты пузырьками кислорода и водорода.
Повторим, например, опыт с разложением воды (рис. 105) и, когда получим в одном стаканчике А некоторое количество кислорода, а в стаканчике В— водорода, прервем цепь электрического тока, удалим батарею и замкнем зажимы прибора на какой-нибудь реостат В. Амперметр нам покажет, что в цепи имеется вторичный ток обратного направления; в то же время мы заметим, что уровни жидкости в стаканчиках Л ж В начнут подниматься (рис. 105).
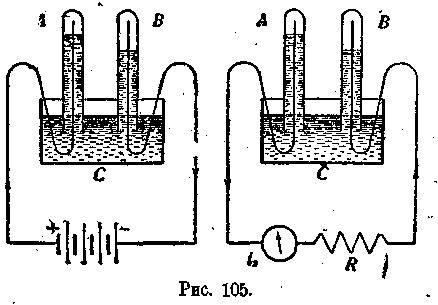 ' Итак, мы в данном случае имеем ' электрический аккумулятор с газообразными продуктами разложе ния; при разложении воды
' Итак, мы в данном случае имеем ' электрический аккумулятор с газообразными продуктами разложе ния; при разложении воды
происходит зарядка акку'мулятора, и мы получаем продукты разложения: кислород и водород. Когда же мы поставим этот аккумулятор на разрядку, кислород снова будет соединяться с водородом, образуя воду, и во внешней цепи появится электрический ток.
Однако иметь дело с газообразными продуктами разложения можно
только, в лабораториях, и для
практической жизни такие газовые "
аккумуляторы мало пригодны. ■
В 1860 году француз Плантэ изобрел прекрасный аккумулятор со свинцовыми электродами, погруженными в раствор серной кислоты, • электродвижущая сила которого равна около двух вольт. Преимущество * свинцового аккумулятора перед газовым заключается в том, что прг. зарядке электрическая энергия превращается в химическую с образо- • ванием твердых химических,, а не газообразных соединений
Действительно, пта зарядке свинцового аккумулятора iia одном^из электродов, соеди: енн ш с положительным полюсом, выделяется кислород, которы? вступает в химическое соединение со свинцом, образуя слой перекиси свинца темно-коричневого цвета. На другом же электроде (отрицательном) выделяется при зарядке водород, который превращает свинец в особое состояние, называемое губчатыж свинцо»
{светло-серого цвета).
Если заряженный свинцовый аккумулятор поставить на разрядку, т. е. замкнуть его на какую-нибудь внешнюю цепь, то будет nponcio-»дить обратное превращение химической энергии в электрическую, причем, конечно, электрический ток в цепи аккумулятора будет иметь обратное направление, а следовательно, теперь на положительном электроде будет выделяться не кислород, а водород, который будет обращать перекись свинца в окись свинца. При этом явление несколько осложняется тем, что серная кислота также принимает участие в образовании химических соединений и в результате в конце разрядки оба электрода покроются осадком сернокислого свинца, или цинкового купороса. При этом в конце разрядки оба электрода станут одинаковыми, вследствие чего электродвижущая сила аккумулятора в конце полной разрядки обратится в нуль, хотя обычно до такого состояния аккумулятор не разряжают.
Не трудно догадаться, что количество электрической энергии, которое можно запасти при зарядке свинцового аккумулятора, находится в зависимости от толщины слоя перекиси свинца на положительном электроде и разрыхленного губчатого свинца на отрицательном электроде. Поэтому приходится производить несколько продолжительных зарядок и разрядок нового аккумулятора, причем с каждым разом на' свинцовых пластинах образуются большие количества перекиси свинца и губчатог„о свинца. Такой процесс называется формовкой аккумулятора и он обходится сравнительно дорого.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.