Итак, опыт с электролизом воды 2 показал нам, что вода является не чем иным, как химическим соединением кислорода с водородом, причем водорода в ней по объему в два раза больше, чем кислорода, что вполне соответствует химической формуле воды (Н2О).
§46. Электролиз кислот и солей.
Если взять раствор какой-нибудь гаслоты или соли и подвергнуть его действию электрического тока, то он разлагается на свой составные части, причем всегда частицы водорода и металлов направляются по току и осаждаются на катоде, т. е. на отрицательном электроде. Так, например, если взять раствор обыкновенной поваренной соли (NaCl), то под действием, электрического тока он разлагается на металл — натрий (Na) и газ4^- -'\ хлор (С1). Металл натрий идет по напраправленшё* тока, соединяется с водой и образует так называемый едкий натр (NaOH).
Возьмем раствор соли медного купороса. Медный 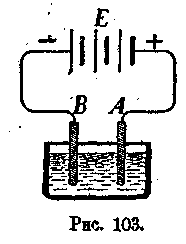 купорос
продается в кристаллах синего цвета,
купорос
продается в кристаллах синего цвета,
![]() 1
Водород легче воздуха и потому он не выйдет из стаканчика, если последний приподнять дном вверх, не перевертывая его.
'
1
Водород легче воздуха и потому он не выйдет из стаканчика, если последний приподнять дном вверх, не перевертывая его.
'
8 При электролизе воды наблюдается поляризация электродов (см. стр> 48), причем электродвижущая сила поляризации равна около 1,5 вольта. А потому для ггого, чтобы произвести разложение воды, нужно взять' батарею, электродвижущая сила которой больше 1,5 вольта, т. е. нужно взять не менее двух гальванических элементов, соединенных друг с другом последовательно.
представляющих химическое соединение меди, серы и кислорода (Со8О,)Ш Если этот раствор подвергнуть действию электрического тока (рис. 103Ш| то произойдет разложение медного купороса, причем,'медь (Си) выдв*|я лнтся из раствора и тонким слоем покроет электрод В, соединенны!!! с отрицательным полюсом батареи Е; около же электрода А, соединен-1| ного с положительным полюсом батареи, выделится остаток медного щ купороса (SO4), который превратится в серную кислоту (H2SO4), причем | будет выделяться кислород. Если электрод А взяТь из меди, то он по- § степенно будет растворяться, поддерживая раствор медного купороса | в насыщенном состоянии. Если же электрод А (анод) взять из угля ;■ или другого металла, на который серная янс'лота не действует, то '■! такой электрод не будет изменяться, а растврр медного купороса будет < постепенно становиться все слабее и слабее. В этом случае к раствору ., добавляют кристаллы медного купороса, которые будут постепенно растворяться, поддерживая раствор в насыщенном состоянии.
§ 47. Завой Фарадея.
Английский ученый Фарадей, занимаясь изучением явления электролиза, открыл следующий закон:
Количество виде, тшегоея при электролизе вещества про
порционально
количеству электричества, прошедшему через
электролит, и не зависит от крепости раствора, его
температуры и
других условий. , «~
^—-"'Мы знаем, что сидой тока называется количество электричества JI Недошедшее в секунду через попер^ттюо сечение данного проводника^ Если же мы будем наблюдать явлении электролиза в течение tсекунда-то количество электричества пройдет в t*раз большее, чем в одну секунду. Одним словом, количество электричества, прошедшее по данному проводнику пли прошедшее через данный раствор, равно произведению из силы тока / на время t. Если' сила тока измеряется амперами, время выражено в секундах, то количество электричества будет измеряться аиперсекундами.
Если произвести электролиз медного купороса (CuSOJ (см. стр. 85) и взвесить катод до электролиза и после, то по разности весов можно определить количество отложившейся меди в миллиграммах. Допустим, что в течение 16 минут при токе, силой 2 ампера, выделилась* на катоде 6бО мг меди. Очевидно, при этом через раствор прошло количество электричества, равное
16 X 60 X 2 = 1920 алгперсеяунд.
Всего выделилось 630 мг медн; следовательно, при прохождении каждой амперсекунды выделилось:
Yg20= 0,328 мг меди. .
Количество вщвстоа в миллиграммах, выделяющееся на электроде при прохождении через него количества алектричл
ства, равного одной амперсекунде, называется элеврохитиче-скии эквивалентом этого вещества. Мы только что видели, чти электрохимический эквивалент меди равен 0,328.
 Приведем небольшую таблицу
электрохимических эквивалентов некоторых веществ:
Приведем небольшую таблицу
электрохимических эквивалентов некоторых веществ:
Итак, если мы хотим узнать, какое количество вещества выделится на катоде при электролизе, нужно электрохимический эквивалент вещества умножить на силу тока в амперах и время прохождения тока в секундах; в этом случав количество выделившегося вещества будет выражено в миллиграммах.
Пример 47. Какое количество медн выделится током, силою .1,5 ампера, в течение получаса из раствора медного купороса (CuSO4)?
Решение. Электрохимический эквивалент меди равен 0,328, а время,прохождения тока, выраженное в секундах, равно 60 X 30 = 1800 секундам, а потому " количество выделившейся меди будет равно:
0,328 X 1,5 X 1800 = 885,6 мг, или равно 0,8856 г.
Пример 48. Какое количество серебра вндел^тся из раствора ляписа (азотно-киелого серебра AgNO8), если через него пропускать ток, силой 0,8 ампера в течение 20 минут?
Решение. Электрохимический эквивалент серебра равен 1,118, а время прохождения тока, выраженное в секундах, равно 60 X 20 = 1200 секундам, а потому количество отложившегося на катоде серебра равно:
1,118 X 0,8 X 1200 = 1073,28 мг,
ми 1,013 г. ' - . ■
§ 48. Гальваническое золочение, серебрение и никкелирование
При помощи, электролиза можно покрывать металлические вещи слоем золота, серебра или никкеля. Такой процесс часто называют гальваническим ролечением, серебрением или никкелированием.
На практике
применяют много разных рецептов для составления
ванн при золочении, серебрении и никкелированищ мы же укажем
только на некоторые из них.'
Для золочения
составляют ванну и» 2 г хлористого золота, растворенных в 2 д воды с
добавлением небольшого кбжнчества цианистого
кадия. л
Для гальванического серебрения берут ванну из 25 г азотяо- кислого
серебра (AgNO3) на литр воды с небольшой прпмесью циани-iстого калия. -
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.