40.Равновесие системы в тепловом контакте. Температура. Энергия и температура.
Пусть 2 подсистемы I и II составляют замкнутую систему.
Они могут обмениваться энергией ![]() .Полная энергия:
.Полная энергия: ![]() .
.
![]() - число доступных состояний i-ой подсистемы. Число частиц и объемы подсистем – постоянны.
- число доступных состояний i-ой подсистемы. Число частиц и объемы подсистем – постоянны.
Доступные состояния газа определяются только энергией и объемом
сосуда, и не зависят от квантовых состояний твердого тела. Найдем число
доступных состояний замкнутой системы через ![]() и
и ![]() .Будем комбинировать первое состояние из
набора
.Будем комбинировать первое состояние из
набора ![]() с доступными состояниями из второго набора
дает
с доступными состояниями из второго набора
дает ![]() доступных состояний замкнутой системы.
доступных состояний замкнутой системы.
Для других состояний из первого набора – будет тот же результат.
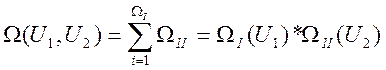 .
.
Это функция должна быть максимальной(из постулатов), т.е.: ![]()
В другом виде: 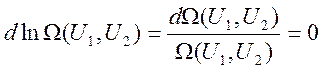 (1)
(1)
Прологарифмируем: ![]()
![]() (2)
(2)
Тогда условие (1) примет вид:
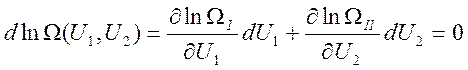
Условие замкнутости: ![]() ,
тогда:
,
тогда:
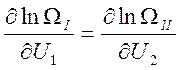 , т.к. это функции независимых
переменных, то равенство такое может быть лишь тогда, когда они равны какой-то
константе:
, т.к. это функции независимых
переменных, то равенство такое может быть лишь тогда, когда они равны какой-то
константе: 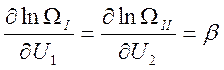
Необходимым
и достаточным свойством равновесия систем в тепловом контакте является наличие
общего для 2-х подсистем параметра ![]() .
.
Умножим (2) на множитель ![]() и
получим:
и
получим: ![]() . Энтропия составной системы равна сумме энтропий подсистем.
. Энтропия составной системы равна сумме энтропий подсистем.
Другое условие равновесия: 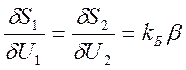 .
.
Введем новую физическую величину – температуру: 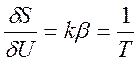
С учетом того, что температура вычисляется при постоянном
числе частиц и постоянном объеме, то определение температуры примет вид: 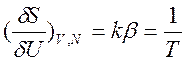
Рассмотрим 2 подсистемы, близкие к равновесию с T1 и Т2:
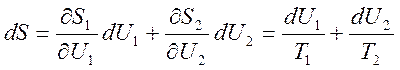
В равновесии энтропия максимальна, значит при переходе к
равновесию dS>0. Пусть ![]() ,
учитывая
,
учитывая ![]() , энтропия будет возрастать(dS>0), если
, энтропия будет возрастать(dS>0), если ![]() и
и ![]()
То энергия второй подсистемы увеличивается, а первой – уменьшается, то есть энергия(тепло) передается от подсистемы с большой температурой в подсистему с меньшей температурой.
41.Равновесие системы в диффузионном контакте. Химический потенциал. Химический потенциал и потоки частиц.
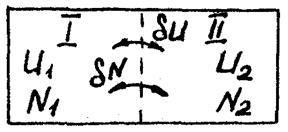 Рассмотрим
условия равновесия для двух подсистем, которые обмениваются не только энергией,
но и частицами. Такой контакт называется диффузионным. Пусть подсистема I обладает энергией U1 и числом частиц N1,
а подсистема II – энергией
U2 и числом частиц N2 (см. рис.) Система из двух подсистем
замкнута. То есть:
Рассмотрим
условия равновесия для двух подсистем, которые обмениваются не только энергией,
но и частицами. Такой контакт называется диффузионным. Пусть подсистема I обладает энергией U1 и числом частиц N1,
а подсистема II – энергией
U2 и числом частиц N2 (см. рис.) Система из двух подсистем
замкнута. То есть:
Обозначим
через ![]() и
и ![]() число
доступных состояний первой и второй подсистем, соответственно.
число
доступных состояний первой и второй подсистем, соответственно.
Число доступных состояний замкнутой системы определяется формулой
![]()
Условие
максимума ![]() принимает вид
принимает вид
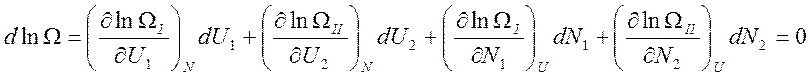
Равенство нулю последнего соотношения возможно при выполнении двух условий:
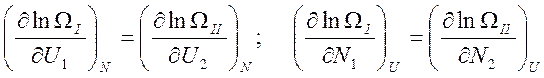
Первое условие
известно и совпадает с условием 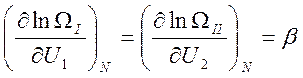 . Второе – требует
введения нового параметра: равновесия:
. Второе – требует
введения нового параметра: равновесия:
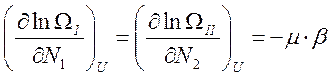
Параметр µ называется химическим потенциалом.
Через энтропию химический потенциал будет определяться формулой
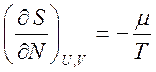
Рассмотрим теперь две подсистемы, близкие к равновесию с одинаковыми температурами, но разными химическими потенциалами. Энтропия замкнутой системы имеет вид
![]()
Вычислим полный дифференциал
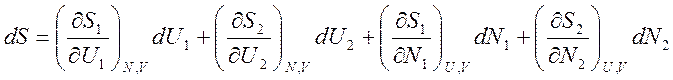
Учитывая, что 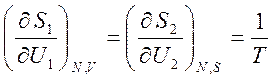 , получаем
, получаем
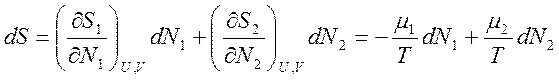
Пусть ![]() . Энтропия будет прирастать (
. Энтропия будет прирастать (![]() ), если
), если ![]() и
и ![]() . Это означает, что при переходе к
равновесию частицы переходят из области с большим химическим потенциалом в
область с меньшим химическим потенциалом.
. Это означает, что при переходе к
равновесию частицы переходят из области с большим химическим потенциалом в
область с меньшим химическим потенциалом.
42.Каноническое распределение Больцмана.
Пусть система С находится в квантовом состоянии с энергией εi (см. рис.). Полная энергия замкнутой макросистемы постоянна:
![]()
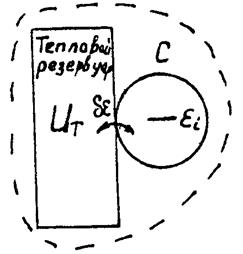 Система
С, переходя по состояниям, может быть обнаружена в них с различной
вероятностью. Вычислим вероятность обнаружения системы С в квантовом
состоянии с энергией εi. Для
этого необходимо подсчитать число доступных состояний замкнутой макросистемы
Система
С, переходя по состояниям, может быть обнаружена в них с различной
вероятностью. Вычислим вероятность обнаружения системы С в квантовом
состоянии с энергией εi. Для
этого необходимо подсчитать число доступных состояний замкнутой макросистемы ![]() , когда система С находится в i-м
квантовом состоянии. Величина
, когда система С находится в i-м
квантовом состоянии. Величина ![]() определится только
доступными состояниями термостата, так как i-е
квантовое состояние системы С единственное. Обозначая
определится только
доступными состояниями термостата, так как i-е
квантовое состояние системы С единственное. Обозначая ![]() число доступных состояний термостата,
получаем
число доступных состояний термостата,
получаем
![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.