На рис. изображены энергетические состояния атома водорода. Вдоль вертикальной оси отложена энергия состояний. Параллельно оси приведены значения главного числа n. Вдоль горизонтальной оси приведены значения орбитального квантового числа, а также соответствующие обозначения состояний с разными значениями l. Энергетические уровни для состояний с различными значениями n и l изображены горизонтальными короткими линиями. Линии, соответствующие одному и тому же значению n, лежат на одной горизонтальной прямой, так как энергия состояний зависит только от главного квантового числа.
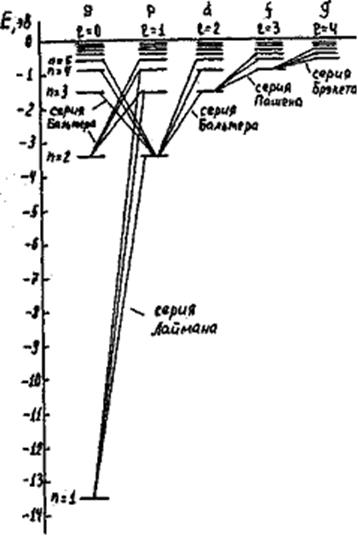 Как следует из правила отбора, возможными являются переходы
в состояния, соседние по l, например s-p , p-s , d-p и т.д. На рис.
наклонными линиями показаны соответствующие разрешенные переходы. Совокупности
переходов между состояниями, имеющими одинаковые начальные и одинаковые
конечные значения l, и образуют спектральные серии. Соответствующие названия
серий приведены на рис.
Как следует из правила отбора, возможными являются переходы
в состояния, соседние по l, например s-p , p-s , d-p и т.д. На рис.
наклонными линиями показаны соответствующие разрешенные переходы. Совокупности
переходов между состояниями, имеющими одинаковые начальные и одинаковые
конечные значения l, и образуют спектральные серии. Соответствующие названия
серий приведены на рис.
Все спектральные серии подчиняются известному правилу, которое
первоначально было получено эмпирическим путем. В соответствии с этим правилом,
частоты излучения для различных линий спектральных серий могут быть найдены по
формуле Бальмера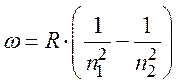 где R=2,07∙1016
с-1 – постоянная Ридберга; n1, n2 – целые числа.
Частоты излучения одной и той же серии получаются при фиксированном значении n1 и разных значениях n2 . Например, для серии Лаймана n1=1 , для серии Бальмера n1=2 и т.д. Расчеты показывают, что только серия Бальмера
попадает в видимую часть оптического диапазона. Серия Лаймана целиком лежит в
ультрафиолетовой части спектра, остальные – в области инфракрасного излучения.
где R=2,07∙1016
с-1 – постоянная Ридберга; n1, n2 – целые числа.
Частоты излучения одной и той же серии получаются при фиксированном значении n1 и разных значениях n2 . Например, для серии Лаймана n1=1 , для серии Бальмера n1=2 и т.д. Расчеты показывают, что только серия Бальмера
попадает в видимую часть оптического диапазона. Серия Лаймана целиком лежит в
ультрафиолетовой части спектра, остальные – в области инфракрасного излучения.
Тонкая структура спектров (или тонкая структура атомных уровней).
Оказывается, если наблюдать атомные спектры с помощью приборов, имеющих высокое разрешение, то можно обнаружить, что многим переходам соответствует не одна линия в спектре (частота или длина волны), а две близко лежащие.
Происхождение тонкой структуры связано со следующим.
Орбитальное движение электрона в атоме создает магнитный момент, который
пропорционален орбитальному механическому моменту ![]() . Аналогично,
с собственным (спиновым) механическим моментом электрона связан спиновый или
собственный магнитный момент. Он, в свою очередь, пропорционален величине
спинового механического момента
. Аналогично,
с собственным (спиновым) механическим моментом электрона связан спиновый или
собственный магнитный момент. Он, в свою очередь, пропорционален величине
спинового механического момента ![]() . Спиновый магнитный
момент электрона взаимодействует с магнитным моментом, связанным с орбитальным
движением. Это взаимодействие называется спин-орбитальным. Его энергия зависит
от взаимной ориентации
. Спиновый магнитный
момент электрона взаимодействует с магнитным моментом, связанным с орбитальным
движением. Это взаимодействие называется спин-орбитальным. Его энергия зависит
от взаимной ориентации ![]() . Так как возможны лишь
две ориентации спина по отношению к выделенному направлению_(«спин вверх» и
«спин вниз»), то и взаимных ориентаций может быть только две. При одной
ориентации энергия спин-орбитального взаимодействия прибавляется к энергии
соответствующего электронного уровня, при другой – вычитается. В результате
происходит расщепление уровня на два подуровня (говорят, что соответствующий
уровень является дублетным). Однако такое происходит не со всеми уровнями: s-уровни не
расщепляются. Это связано с тем, что в s -состояниях электронное облако имеет сферическую симметрию
относительно ядра, а орбитальные механический и магнитный моменты для такого
распределения равны нулю. Следовательно, в s-состояниях
спин-орбитальное взаимодействие отсутствует, а соответствующие энергетические
уровни не расщепляются (являются синглетными). Энергия спин-орбитального
взаимодействия весьма мала. Поэтому соответствующие два подуровня лежат очень
близко друг к другу. По этой же причине при оптических переходах ориентация
спина электрона не меняется. Последнее дает еще одно правило отбора при
оптических переходах:
. Так как возможны лишь
две ориентации спина по отношению к выделенному направлению_(«спин вверх» и
«спин вниз»), то и взаимных ориентаций может быть только две. При одной
ориентации энергия спин-орбитального взаимодействия прибавляется к энергии
соответствующего электронного уровня, при другой – вычитается. В результате
происходит расщепление уровня на два подуровня (говорят, что соответствующий
уровень является дублетным). Однако такое происходит не со всеми уровнями: s-уровни не
расщепляются. Это связано с тем, что в s -состояниях электронное облако имеет сферическую симметрию
относительно ядра, а орбитальные механический и магнитный моменты для такого
распределения равны нулю. Следовательно, в s-состояниях
спин-орбитальное взаимодействие отсутствует, а соответствующие энергетические
уровни не расщепляются (являются синглетными). Энергия спин-орбитального
взаимодействия весьма мала. Поэтому соответствующие два подуровня лежат очень
близко друг к другу. По этой же причине при оптических переходах ориентация
спина электрона не меняется. Последнее дает еще одно правило отбора при
оптических переходах: ![]()
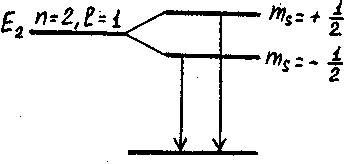 На рис. изображены два электронных уровня: основной, для
которого n=1, l=0 (s-состояние), и возбужденный, у которого n=2, l=1. Как видно
из рисунка, основное состояние является синглетным, возбужденное – дублетным.
Поэтому возможны два оптических перехода из возбужденного состояния в основное,
чему будут соответствовать две близкие частоты излучения и соответственно – две
линии в спектре.
На рис. изображены два электронных уровня: основной, для
которого n=1, l=0 (s-состояние), и возбужденный, у которого n=2, l=1. Как видно
из рисунка, основное состояние является синглетным, возбужденное – дублетным.
Поэтому возможны два оптических перехода из возбужденного состояния в основное,
чему будут соответствовать две близкие частоты излучения и соответственно – две
линии в спектре.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.