Принцип Ле Шателье определяет смещение химического и фазового равновесия при изменении температуры, давления и состава системы.
Пример для химической системы: в химической реакции образования аммиака из азота и водорода при увеличении давления равновесной смеси азота, водорода и аммиака равновесие смещается в сторону образования аммиака (образование одной молекулы вместо исходных двух уменьшает давление).
Пример для физической системы: если подводить тепло к равновесной системе «лёд-жидкая вода» (пытаться увеличить ее температуру), то лёд начнет плавиться (при плавлении льда поглощается тепло, что способствует уменьшению температуры) и до тех пор, пока существует лёд, температура остается постоянной, повысить ее невозможно.
О выполнении принципа Ле Шателье в социально-экономических системах упоминал еще в 20-х годах прошлого (ХХ) века Богданов А.А. - ученый, известный многим как автор «Всеобщей организационной науки (тектологии):
«Закона Ле Шателье нам придется опять коснуться, поэтому я его формулирую. Закон равновесия относится к определенному типу систем, которые так и называются системами равновесия, и эти системы характеризуются тем, что если на них производится какое-нибудь воздействие извне, которое, значит, их изменяет, то в них возникают измения, стремящиеся противодействовать, ослабляющие это внешнее воздействие… Общество не только в своей материальной жизни, но и в своей интеллектуальной, в данном случае в своем научном сознании, принадлежит к типу систем Ле Шателье, систем равновесия, то есть на внешние, изменяющиеся воздействия реагирует такими свойствами изменений, которые этому противодействуют» [Богданов А.А. Из доклада, прочитанного на заседании Социалистической Академии Наук в 1923 г. «Общественно-научное значение новейших тенденций естествознания»].
Пример выполнения принципа Ле Шателье в экономике - широко известный «принцип невидимой руки рынка» Адама Смита, «кривая спроса» (увеличение объема товаров влечет за собой уменьшение их цены, так как доход должен оставаться постоянным в совершенной экономике), эффект «равновесной цены», снижение объемов производства при увеличении прибавочной стоимости и т.д.
3.2. Закон действующих масс: экономический процесс,
как «химическая реакция» (автокатализ, автоколебательные и хаотические процессы в химии и экономике)
Экономический процесс можно представить как химическую реакцию. Например, продукт труда R (жизненное благо) можно рассматривать как результат взаимодействия работника (реагент А) со средствами производства (реагент В).
Химическая реакция между двумя веществами записывается как
![]() , где
A, B–
молярные концентрации реагентов, а R – продукта реакции; c,
m, z – стехиометрические
коэффициенты; r–
константа скорости прямой реакции.
, где
A, B–
молярные концентрации реагентов, а R – продукта реакции; c,
m, z – стехиометрические
коэффициенты; r–
константа скорости прямой реакции.
Скорости химической реакции подчиняются закону действующих масс.
Закон действующих (действия) масс: скорость химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции.
Согласно закону действующих масс скорость прямой реакции v:
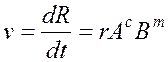
В случае автокаталитической реакции (один из исходных реагентов является продуктом реакции: самоускоряющейся реакции, если константа скорости положительна, или самозамедляющейся реакции, если константа скорости отрицательна) с неограниченным ресурсом (А):
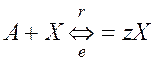 , где
e – константа скорости обратной реакции, скорость
прямой реакции описывается линейным дифференциальным уравнением
, где
e – константа скорости обратной реакции, скорость
прямой реакции описывается линейным дифференциальным уравнением
![]() ,
,
где
![]() .
Накопление продукта реакции в этом случае описывается уравнением:
.
Накопление продукта реакции в этом случае описывается уравнением:
![]() ,
,
то есть количество продукта увеличивается экспоненциально. Это дифференциальное уравнение реакции для упрощения расчета количества продукта можно превратить в итерационное уравнение (с дискретным временем)
![]() .
.
Схема зависимости последующего количества продукта
автокаталитического процесса ![]() (ось
ординат) от предыдущего значения
(ось
ординат) от предыдущего значения ![]() (ось
абсцисс) при неограниченном ресурсе представлена на рис. 3.1.
(ось
абсцисс) при неограниченном ресурсе представлена на рис. 3.1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.