Таким образом, для разбавленных водных
растворов кислот и оснований, ионизирующихся с образованием однозарядного иона,
можно записать следующие уравнения для определения ![]() :
:
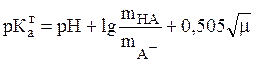 (20)
(20)
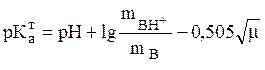 (21)
(21)
Константы ионизации, полученные из этих уравнений, являются истинными или термодинамическими, не зависящими от концентраций кислот и оснований. При определении констант ионизации методом потенциометрического титрования часто пренебрегают поправкой на коэффициент активности и получают так называемые смешанные константы ионизации:
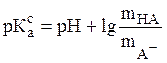 (22)
(22)
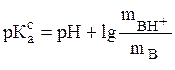 (23)
(23)
Смешанные константы ионизации незначительно отличаются от термодинамических при условии, что концентрации кислот и оснований не превышают 0,01 М. Однако если решено внести термодинамическую поправку в эти величины, то достаточно близкое приближение можно получить с помощью уравнений:
для кислот ![]() (24)
(24)
для оснований ![]() (25)
(25)
где ![]() – ионная сила
раствора в средней точке титрования, а
– ионная сила
раствора в средней точке титрования, а ![]() – среднее значение
– среднее значение ![]() из серии результатов, полученных в одном эксперименте.
из серии результатов, полученных в одном эксперименте.
В качестве примера рассмотрим процесс титрования слабой одноосновной кислоты НА сильным однокислотным основанием КОН:
НА + КОН ® КА + Н2О (26)
Обозначим:
А м/л – исходная концентрация кислоты
В м/л – количество добавленной щелочи в пересчете на концентрацию в получившемся растворе.
В связи с тем, что все соли в растворе
полностью ионизированы, величина ![]() равна В, т.е.
концентрации КОН с учетом разбавления ее раствором. Исходную концентрацию
кислоты можно определить через концентрацию оставшейся кислоты и концентрацию
образовавшейся соли (концентрацию аниона А–):
равна В, т.е.
концентрации КОН с учетом разбавления ее раствором. Исходную концентрацию
кислоты можно определить через концентрацию оставшейся кислоты и концентрацию
образовавшейся соли (концентрацию аниона А–):
A = mHA + ![]() (27)
(27)
В любой момент титрования раствор должен быть электронейтральным, т.е. сумма концентраций отрицательных ионов должна быть равна сумме концентраций положительных ионов:
![]() +
+ ![]() =
= ![]() +
+ ![]() , (28)
, (28)
откуда
![]() =
= ![]() –
– ![]() +
+ ![]() = B –
= B – ![]() +
+ ![]() .
(29)
.
(29)
Решая совместно уравнения (27) и (29), получим
![]() = A – B +
= A – B + ![]() –
– ![]() .
(30)
.
(30)
Разделив почленно (30) на (29), получим
отношение ![]() к
к ![]() :
:
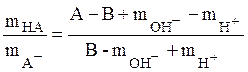 . (31)
. (31)
Уравнение (31) совместно с уравнением (20)
позволяет нам рассчитывать ![]() слабой кислоты,
титруемой КОН. Величина рН в каждой точке титрования определяется с помощью
рН-метра.
слабой кислоты,
титруемой КОН. Величина рН в каждой точке титрования определяется с помощью
рН-метра.
Если результаты титрования лежат в области рН = 4–10, то поправкой на ионы водорода и гидроксила можно пренебречь, и уравнение (31) в этом случае можно записать в виде
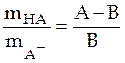 при 4 < pH < 10. (32)
при 4 < pH < 10. (32)
В кислой и щелочной областях уравнение (31) запишется соответственно
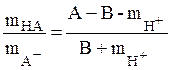 при pH £
4 (33)
при pH £
4 (33)
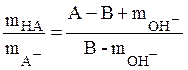 при рН ³ 10 (34)
при рН ³ 10 (34)
В некоторых случаях константу ионизации слабой одноосновной кислоты определяют путем титрования ее соли сильной кислотой НСl.
Отношение 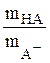 в этом случае находят
из уравнений:
в этом случае находят
из уравнений:
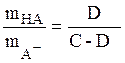 при 4 < pH < 10
при 4 < pH < 10
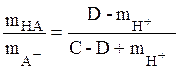 при pH £
4 (35)
при pH £
4 (35)
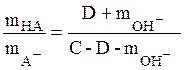 при рН ³ 10
при рН ³ 10
где С м/л – исходная концентрация соли слабой одноосновной кислоты, D м/л – количество добавленной НС1 в пересчете на концентрацию в получившемся растворе.
Расчет констант ионизации слабых однокислотных оснований при титровании их сильной кислотой (НСl) проводится подобным же образом, исходя из уравнения (21) и уравнений, аналогичным таковым для кислот:
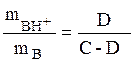 при 4 < pH < 10
при 4 < pH < 10
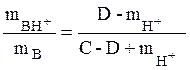 при pH £
4 (36)
при pH £
4 (36)
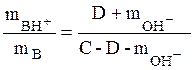 при рН ³ 10
при рН ³ 10
где С м/л – исходная концентрация основания, D м/л – количество добавленной сильной кислоты в пересчете на концентрацию в получившемся растворе.
При обратном титровании солей слабых однокислотных оснований сильной щелочью (КОН) получаем следующие уравнения:
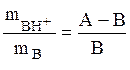 при 4 < pH < 10
при 4 < pH < 10
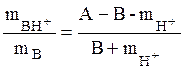 при pH £
4 (37)
при pH £
4 (37)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.