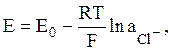
где Е0 = 0,2224 В при 25°С.
2.5. Электроды, применяемые при измерении рН растворов
Зависимость потенциала водородного электрода от активности ионов водорода дается уравнением
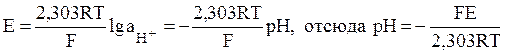
где 2,303 – коэффициент перехода от натурального к десятичному логарифму.
Таким образом, по значению ЭДС элемента, составленного из водородного электрода и электрода сравнения, опущенных в исследуемый раствор, можно определить рН этого раствора. Однако водородный электрод не очень удобен в работе.
Применяемый в рН-метрии стеклянный электрод изготовляется из специальных сортов стекла, обладающих проводимостью, обусловленной перемещением в нем ионов Н+. Он представляет собой стеклянную трубку с шариком на конце. В трубку залита суспензия AgCl в растворе HCl и погружена серебряная проволока. Для измерения рН стеклянный электрод погружают в исследуемый раствор:
![]()
Перенос электронов от хлорсеребряного к электроду сравнения сопровождается переносом эквивалентного количества протонов из внутренней части стеклянного электрода (раствора HCl) в исследуемый раствор.
В этой цепи имеется три скачка потенциала: e1 – потенциал хлорсеребряного электрода, e2 и e3 – потенциалы стекла по отношению к растворам, содержащим ионы водорода. Уравнение Нернста для e2 и e3 аналогично таковому для водородного электрода:
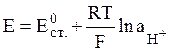 , где Е = e2 или e3
, где Е = e2 или e3
![]() зависит от сорта
стекла.
зависит от сорта
стекла.
При работе стеклянного электрода величины e1 и e2 не меняются, поэтому потенциал электрода можно записать так:
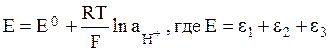 ,
,
а
Е0 включает в себя ![]() и потенциал хлорсеребряного электрода.
и потенциал хлорсеребряного электрода.
И, наконец,
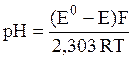
Так как в Е0 входят величины, индивидуальные для каждого электрода, величина Е0 определяется калибровкой по буферному раствору с рН, близкой к рН исследуемых растворов.
2.6. Определение констант ионизации кислот и оснований
потенциометрическим методом
![]() Одной из наиболее
важных задач потенциометрии является определение концентрации ионов водорода, а
также потенциометрическое титрование – наиболее удобный и быстрый метод
определения констант ионизации кислот и оснований. Рассмотрим процесс ионизации.
Для кислот он может быть представлен в следующем виде:
Одной из наиболее
важных задач потенциометрии является определение концентрации ионов водорода, а
также потенциометрическое титрование – наиболее удобный и быстрый метод
определения констант ионизации кислот и оснований. Рассмотрим процесс ионизации.
Для кислот он может быть представлен в следующем виде:
(6)
где
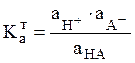 (7)
(7)
![]() есть константа ионизации кислоты НА. Для оснований
состояние ионного равновесия также можно описать кислотной константой ионизации
есть константа ионизации кислоты НА. Для оснований
состояние ионного равновесия также можно описать кислотной константой ионизации
(8)
где
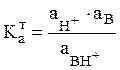 (9)
(9)
есть константа ионизации сопряженной с основанием В кислоты ВН+. Константы ионизации – величины малые, и поэтому удобнее пользоваться их отрицательными логарифмами
![]() (10)
(10)
Прологарифмировав выражения (7, 9) и
поменяв знаки на обратные, получим следующие уравнения для![]()
для кислот: 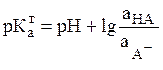 ; (11)
; (11)
и для оснований: 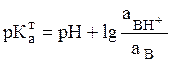 ;
(12)
;
(12)
где рН = – lg![]() (13)
(13)
Далее перейдем от активностей к концентрациям, приняв во внимание, что активности неионизированных кислот НА и оснований В в разбавленных растворах практически равны их концентрациям, а зависимость активности любого иона от его концентрации выражается уравнением
an = mn × gn, (14)
где gn – коэффициент активности иона, а mn – его молярная концентрация.
Учитывая (14), уравнения (11) и (12) можно записать в следующем виде
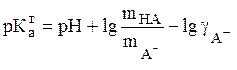 (15)
(15)
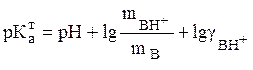 (16)
(16)
Согласно теории Дебая-Гюккеля, коэффициент активности однозарядного иона определяется формулой
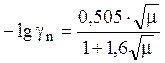 , (17)
, (17)
где m – ионная сила раствора, вычисляемая по формуле
m = 0,5 Smn ×![]() (18)
(18)
где mi – концентрация i-го иона в молях/литр, а zi – заряд иона в электронных единицах. Для 1,1 – валентного электролита zi = 1. При расчете ионной силы учитывают все ионы, находящиеся в растворе.
Для 0,01 M и более разбавленных растворов можно пренебречь знаменателем в уравнении (17), и в этом случае оно еще более упрощается:
![]() (19)
(19)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.