Для разделения способных к ионизации соединений (например, нуклеотидов, нуклеиновых кислот, аминокислот и т.п.) широко используется ионообменная хроматография. Обычно применяют хроматографию на колонке, но для анализа и идентификации микроколичеств веществ можно использовать также бумагу, изготовленную из порошка ионита. При этом механизм разделения веществ будет тот же, что и при хроматографии на колонке, но по внешнему оформлению процесс больше похож на хроматографию на бумаге.
В качестве подвижной фазы применяют различные буферные растворы. Движение подвижной фазы осуществляется за счет сил капиллярного смачивания.
В качестве анионообменника широко используют DEАE-целлюлозу, которая представляет собой природный полимер (целлюлозу) с введенными в него диэтиламиноэтильными (DEАE) группами. Cxeматично ее можно изобразить следующим образом:
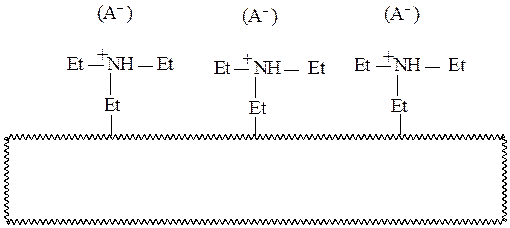
Волнистой линией здесь изображена нерастворимая целлюлозная матрица, Et – этильная группа, а (А–) – противоионы, способные обмениваться на другие анионы, находящиеся в разделяемой смеси.
Емкость ионообменника зависит от рН раствора, т. к. в зависимости от рН изменяется количество заряженных групп на поверхности сорбента. Для DEАE-целлюлозы при рН<10 емкость колеблется в зависимости от сорта в диапазоне 0,4–1,0 мг-моль/г. Верхний предел рН обусловлен величиной рК аминогрупп DEАE-целлюлозы (рКа » 10) (подумайте, на сколько изменится емкость DEАE-целлюлозы по сравнению с рН7 при: 1) рН = 10; 2) рН = 11).
Разделение смеси АМP, АDP и АТP при хроматографии на DEАE-бумаге в системе 4 М муравьиная кислота – 0,1 M формиат аммония (рН = 1,8) осуществляется вследствие различия у данных веществ коэффициентов распределения a за счет разной величины их отрицательного заряда.
При кислых значениях рН соотношение отрицательных зарядов у АМP, АDP и АТP будет соответственно 1 : 2 : 3, а не 2 : 3 : 4, как было бы в нейтральной (или щелочной) среде. Это связано с тем, что в кислой среде концевой фосфат не полностью ионизован. Поэтому применение в качестве подвижной фазы кислого буферного раствора существенно улучшает разделение этих соединений. Формулы этих веществ при рН = 1,8 выглядят следующим образом:
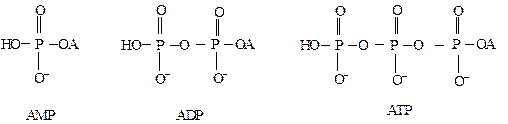
где А – остаток аденозина.
Экспериментальная часть

Лист DEАE-бумаги 140 х 70 мм размечают, как показано выше. Места нанесения веществ на линии старта отмечают и подписывают карандашом. (Линию фронта не отмечают).
На линию старта наносят пятью касаниями 3%-ные водные растворы исследуемой смеси, а также АМP АDP и АТP в качестве свидетелей. Пятна высушивают в токе воздуха. На дно хроматографической камеры наливают » 20 мл буферного раствора. Бумагу закрепляют на стеклянной палочке и опускают ее в камеру так, чтобы нижняя часть ее была погружена в растворитель на 0,5 см.
Внимание! Линия старта должна находиться » на 1 см выше уровня растворителя.
Через 20-30 минут хроматограмму осторожно (DEАE-бумага очень непрочная) вынимают и высушивают. Обнаружение пятен проводят, рассматривая хроматограмму в УФ-свете на ультрахемископе. Пятна обводят карандашом и рассчитывают Rf по формуле (13). По результатам работы оформляют отчет.
Х-3. Разделение смеси нуклеозидов
методом тонкослойной хроматографии на силикагеле
1. Камера для хроматографии.
2. Листы силуфола УФ-254 150 x 50 мм.
3. Ультрахемископ.
4. Капилляры для нанесения растворов веществ.
5. 1% водный раствор смеси нуклеозидов.
6. 1% водные растворы уридина, тимидина, цитидина, аденозина.
7. Система растворителей: хлороформ-метанол-вода (4 : 4 : 1).
Работа посвящена разделению методом ТСХ на силикагеле смеси четырех нуклеозидов (аденозин, цитидин, уридин и тимидин) и их идентификации путем сравнения со свидетелями.
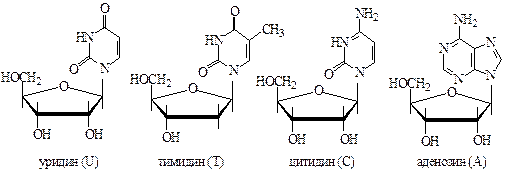
Различия в строении этих нуклеозидов приводят к различной адсорбции их поверхностью силикагеля и, следовательно, к различной скорости движения при хроматографии. В порядке увеличения скорости движения (увеличения Rf) эти вещества располагаются в следующем ряду:
С < А << U < T
В этом же ряду уменьшается полярность молекул.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.