Построить графики зависимости D400 от t. По начальным линейным участкам кинетических кривых вычислить скорости реакций в DD400 / Dt 1/мин., как это показано на рисунке:
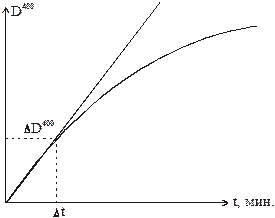
Результаты свести в таблицу:
|
Концентрация субстрата |
|
Далее рассчитать скорости реакций в моль/л×мин, воспользовавшись формулой:
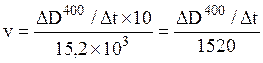 ;
;
где ![]() л/моль·см
– молярный коэффициент экстинкции n-нитрофенола
при 400 нм (см. формулу (9) раздела 1.6.); 10 – коэффициент, учитывающий
разбавление реакционной смеси 0,02 М раствором NaОН при остановке реакции.
л/моль·см
– молярный коэффициент экстинкции n-нитрофенола
при 400 нм (см. формулу (9) раздела 1.6.); 10 – коэффициент, учитывающий
разбавление реакционной смеси 0,02 М раствором NaОН при остановке реакции.
Рассчитанные скорости гидролиза п-нирофенилфосфата, а также обратные им величины свести в таблицу:
|
S, моль/л |
|
v, моль/л×мин |
|
По данным таблицы построить график в
координатах: ![]() –
– ![]() . Из
графика найти значения Vmax
и Km, как это показано на рис.2.
. Из
графика найти значения Vmax
и Km, как это показано на рис.2.
![]()
4. ХРОМАТОГРАФИЯ
4.1. Область приложений
Хроматография – группа современных высокоэффективных методов разделения, основанных на распределении вещества между двумя фазами в сочетании с его перемещением в одной из фаз.
Термин «хроматография» («цветозапись») принадлежит М. С. Цвету, который при анализе растительных пигментов на колонке с углекислым кальцием наблюдал разделение зон различной окраски (1903, 1907 гг.). За открытие жидкостной распределительной хроматографии на колонках (1941 г.), которое впоследствии привело к развитию бумажной хроматографии, Мартин и Синдж были удостоены Нобелевской премии. Мартину и сотр. принадлежит также честь открытия газожидкостной хроматографии (1941, 1952 гг).
Хроматографические методы широко используются в лаборатории и промышленности для качественного и количественного анализа смесей, идентификации веществ, препаративного разделения и очистки. Следует подчеркнуть особую роль этих методов в биохимических исследованиях для анализа и выделения в чистом виде белков, аминокислот, компонентов нуклеиновых кислот, антибиотиков, витаминов и т.д.
Аналитические возможности хроматографии нашли широкое применение в физической химии при изучении равновесий, кинетики и механизма химических реакций, растворимости веществ.
4.2. Коэффициент распределения
Методы равновесной хроматографии основаны на разном распределении разделяемых веществ между фазами.
Рассмотрим систему двух фаз 1 и 2, которые свободно обмениваются частицами и имеют объемы V1 и V2. Среднее число частиц одного сорта в этих подсистемах – N1 и N2. Предполагается, что эти числа достаточно велики, и система находится в термодинамическом равновесии.
Вероятность нахождения частицы в фазе 1 можно определить как отношение числа частиц в этой фазе к общему числу молекул в системе:
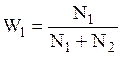 (1)
(1)
Примем во внимание, что после некоторого числа столкновений с другими молекулами в течение времени t1, которое можно назвать cредним временем жизни в состоянии 1, частица переходит в среду 2, затем вновь возвращается в среду 1 и т. д. Обозначим среднее время пребывания частицы в среде 2 как t2.
Поскольку выбранная частица ничем не отличается от других, поведение всех частиц должно быть в среднем таким же. Тогда вероятность нахождения частицы в фазе 1 можно выразить через средние времена «жизни» частицы в двух средах как
W1 = t1/(t1 + t2), (2)
Сравнивая (1) и (2), находим
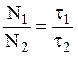 , (3)
, (3)
Концентрация вещества в фазе 1 равна m1, а в фазе 2 – m2:
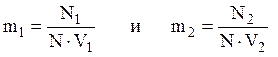
где N – число Авогадро.
Коэффициент распределения частиц a между двумя фазами определяется соотношением сродства вещества к каждой из фаз и равен отношению концентраций вещества в них. Из формулы (3) следует, что
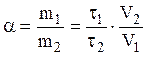 .
(4)
.
(4)
Отсюда следует, что концентрация частиц в некоторой фазе 1 (при заданном объеме) тем больше, чем больше среднее время «жизни» в ней частицы t1 или, что-то же самое, чем меньше подвижность частицы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.