Наиболее медленной, лимитирующей скорость всего процесса, является стадия образования продукта реакции, поэтому начальная скорость реакции равна
v0 = k2[ES] (2)
Скорость накопления комплекса ES равна
d[ES]/dt = k1[E] [S] - k-1[ES] - k2 [ES] (3)
где первый член соответствует скорости образования фермент-субстратного комплекса, а второй и третий – скорости его распада.
Если обозначить общую концентрацию субстрата S, а общую концентрацию фермента Е0, то уравнения баланса по субстрату и ферменту можно представить следующим образом:
S = [S] + [ES] + [P] (4)
Е0 = [ES] + [E] (5)
Практически всегда концентрация субстрата намного больше концентрации фермента, т. е. S >> E0. Следовательно, величиной [ES] по сравнению с [S] в уравнении (4) можно пренебречь. Поскольку мы определяем начальную скорость реакции, то концентрация продукта реакции [P] в этот момент времени близка к нулю. Тогда из уравнения (4) следует, что в начале реакции
[S] ≈ S (6)
Выражая из уравнения (5) концентрацию фермента, получим, что
[E] = E0 – [ES] (7)
Подставляя [S] и [E] из (6) и (7) в уравнение (3), получаем
Решая это уравнение относительно [ES], получаем
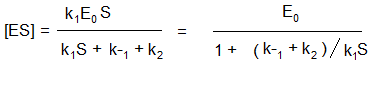
Подставляя значение [ES] в уравнение (2), получаем
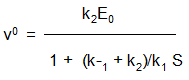
Выражение (k-1 + k2)/k1 обозначим как Кm – константа Михаэлиса. Тогда начальная скорость ферментативной реакции равна
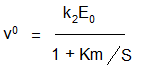
График зависимости v0 от S приведен на рис.1
 |
Рис.1
Видно, что скорость реакции растет с ростом концентрации субстрата и при очень высоких концентрациях субстрата стремится к предельному значению k2E0, которое обозначают как Vmax и называют максимальной скоростью реакции Отсюда получаем уравнение Михаэлиса
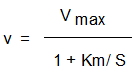
(Значок 0 у обозначения скорости обычно опускают, хотя следует помнить, что речь всегда идет о начальной скорости ферментативной реакции.)
Максимальная скорость реакции Vmax = k2E0 зависит только от концентрации фермента и наблюдается при условии полного насыщения фермента субстратом (когда весь фермент находится в виде комплекса ES). При этих условиях дальнейшее увеличение концентрации субстрата не влияет на скорость реакции.
Из уравнения Михаэлиса вытекает, что при концентрации субстрата S, равной Km, скорость реакции равна Vmax/2. Таким образом, Константа Михаэлиса равна той концентрации субстрата, при которой скорость ферментативой реакции равна половине максимально возможной.
Зная параметры уравнения Михаэлиса Km и Vmax для данной реакции, можно рассчитать ее скорость при любой концентрации субстрата. Для определения этих параметров удобно воспользоваться обратными величинами скорости реакции и концентрации субстрата. Из уравнения Михаэлиса следует, что
1/v = 1/Vmax + Km/Vmax 1/S (8)
Отсюда видно, что график зависимости 1/v от 1/S представляет собой прямую
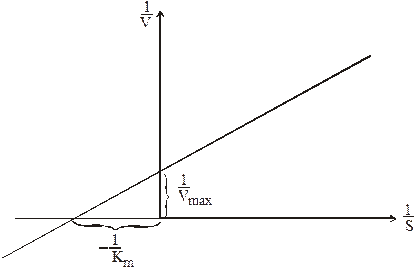
Рис.2
Из уравнения (8) следует, что отрезок, отсекаемый этой прямой на оси ординат, равен 1/Vmax, а отрезок, отсекаемый ею на оси абсцисс, равен -1/ Km. Это позволяет определить параметры уравнения Михаэлиса.
Ниже приведены две задачи по изучению кинетики реакций, одна из которых протекает без участия фермента и предполагает расчет констант скорости и энергии активации процесса, а другая, ферментативная, имеет целью определение величин Km и Vmax.
Приборы и реактивы
1. Круговой спектрополяриметр
2. Термостат
3. Секундомер
4. Раствор 0,6 М HCl
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.