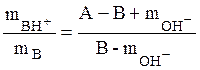 при рН ³ 10
при рН ³ 10
где А м/л – исходная концентрация соли слабого однокислотного основания, В м/л – количество добавленной щелочи в пересчете на концентрацию в получившемся растворе.
Ниже приведены три задачи на определение констант ионизации методом потенциометрического титрования. Лучше всего титровать вещество в 0,01 M концентрации. При этой концентрации отличие активности от концентрации мало, а точность результатов достаточно высока. В качестве титрантов используют 0,1 M растворы НСl и КОН. Применение титранта в десять раз более концентрированного, чем титруемый раствор, позволяет не учитывать разбавление титрантом титруемого раствора, если расчеты базируются на концентрации, которая достигается в средней точке титрования.
П-1. Определение константы ионизации слабого
однокислотного основания методом потенциометрического титрования
Приборы и реактивы
1. Стандартные буферные растворы.
2. Раствор титранта: 0,1 M HCl.
3. Cвободная от карбонатов дистиллированная вода.
4. Трис-оксиметиламинометан («трис»), М.в. 121.14:
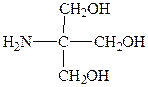
5. Пипетка на 1 мл
6. Стакан для титрования на 100 мл
7. рН-метр
8. Стеклянный электрод
9. Хлорсеребряный электрод
10. Магнитная мешалка
11. Магнитик
12. Термометр
Экспериментальная часть
1. Откалибровать рН-метр по стандартным буферным растворам.
2. Приготовить раствор трис-оксиметиламинометана с концентрацией 0,01 M в точке полунейтрализации, для чего навеску 60,6 мг «триса» растворить в 47,5 мл прокипяченной дистиллированной воды.
3. Измерить температуру титруемого раствора и на температурной шкале рН-метра установить эту же величину.
4. Определить значение рН титруемого pacтвopa «триса». Затем провести титрование десятью порциями раствора титранта, добавляя 0,1 M HCl из пипетки порциями по 0,5 мл. Титрование проводить при перемешивании с помощью магнитной мешалки. Значения рН замерять после каждого добавления порции титранта, как только установится равновесие.
Обработка результатов
Исходя из показаний рН-метра и используя уравнения (23) и (36),
рассчитать ![]() в
каждой точке титрования. Экспериментальные и расчетные данные свести в таблицу:
в
каждой точке титрования. Экспериментальные и расчетные данные свести в таблицу:
|
V 0,1 M HCl, мл |
рН |
|
lg |
|
Далее, усреднив полученную серию
результатов, найти ![]() и
и ![]() . Окончательный
результат представить в виде
. Окончательный
результат представить в виде ![]() ± D
± D![]() , где D
, где D![]() – наибольшее
отклонение в серии значений
– наибольшее
отклонение в серии значений ![]() от средней величины, или разброс этой величины.
от средней величины, или разброс этой величины.
Рассчитать ионную силу раствора в средней
точке титрования по формуле (18). Внеся поправку на коэффициент активности
согласно (25), определить ![]() и
термодинамическую константу ионизации трис-оксиметиламинометана. Полученную
величину сравнить с литературной.
и
термодинамическую константу ионизации трис-оксиметиламинометана. Полученную
величину сравнить с литературной.
П-2. Определение константы ионизации слабой
одноосновной кислоты методом потенциометрического
титрования ее соли сильной кислотой
Приборы и реактивы
1. Стандартные буферные растворы.
2. Раствор титранта: 0,1 M HCl.
3. Cвободная от карбонатов дистиллированная вода.
4. Уксуснокислый натрий безводный, СН3-cooNa,
М.в. = 82,03.
5. Пипетка на 1 мл
6. Стакан для титрования на 100 мл
7. рН-метр
8. Стеклянный электрод
9. Хлорсеребряный электрод
10. Магнитная мешалка
11. Магнитик
Экспериментальная часть
1. Откалибровать рН-метр по стандартным буферным растворам.
2. Приготовить раствор уксуснокислого натрия с концентрацией 0,01 M в точке полунейтрализации, для чего навеску 41 мг уксуснокислого натрия растворить в 47,5 мл прокипяченной дистиллированной воды.
3. Измерить температуру титруемого раствора и на температурной шкале рН-метра установить эту же величину.
4. Определить значение рН титруемого раствора уксуснокислого натрия. Затем провести титрование десятью порциями раствора титранта, добавляя 0,1 М HCl из пипетки порциями по 0,5 мл. Титрование проводить при перемешивании с помощью магнитной мешалки. Значения рН замерять после каждого добавления порции титранта, как только установится равновесие.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.