где АН – слабая кислота, А– – сопряженное основание, m0 – исходная концентрация слабой кислоты, a – степень ее диссоциации. Поскольку Н2О и Н3О+ не поглощают свет, оптическая плотность раствора при длине волны l будет равна
D = L(eAH mAH + eA– mA–), (15)
где mAH и mA– – концентрации молекул недиссоциированной кислоты и её анионов, eAH и eA– – их мольные коэффициенты экстинкции при данной длине волны.
mAH + mA– = m0 (16)
Положение равновесия реакции (14) зависит от кислотности среды. При добавлении сильных кислот равновесие смещается влево. Наоборот, при снижении кислотности среды можно полностью сместить равновесие вправо. Изучая поглощение раствора в достаточно кислой среде, получаем спектр недиссоциированных молекул кислоты. Измеряя поглощение в достаточно щелочной среде, устанавливаем спектр анионов кислоты.
Из уравнения, аналогичного уравнению (12),
D = Lm0eA– + LmAH (eAH – eA–) (17)
следует, что зависимость D от рН среды должна иметь вид, показанный на рис. 6. Переходная область (область резкого изменения D) занимает 2-3 единицы рН. При дальнейшем изменении рН (в сторону больших или меньших значений) D изменяется мало и далее принимает постоянные значения: D = Dкисл и D = Dщел
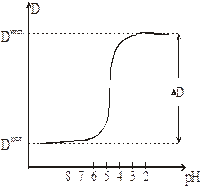
Рис.6
Отсюда можно найти значения экстинкций обоих форм:
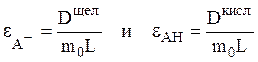 (18)
(18)
Подставляя эти значения в (17), можно найти концентрации mAH и mA– в данном растворе и степень диссоциации кислоты HА:
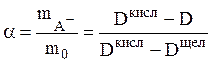 (19)
(19)
|
Рис. 7 |
Рис. 6 отвечает случаю, когда eAН > eA–. Если eAН < eA–, то график будет иметь другой вид (рис. 7). Наконец, если измерения ведутся в изобестической точке, D не будет зависеть от рН: на графике получим горизонтальную прямую. Ясно, что в этом случае определить степень диссоциации нельзя.
1.8. Определение константы диссоциации слабой кислоты
Константа диссоциации кислоты АH равна константе равновесия реакции (14)
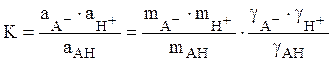 , (20)
, (20)
где ![]() ,
, ![]() ,
, ![]() – активности А–, Н+,
АН; а
– активности А–, Н+,
АН; а ![]() ,
, ![]() ,
, ![]() – коэффициенты активности А–,
Н+, АН.
– коэффициенты активности А–,
Н+, АН.
В случае достаточно разбавленных водных растворов ![]() = 1, а коэффициенты активности ионов можно
определить по формуле Дебая-Гюккеля. При 25°
= 1, а коэффициенты активности ионов можно
определить по формуле Дебая-Гюккеля. При 25°
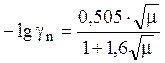 . (21)
. (21)
Здесь m = 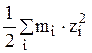 – ионная
сила раствора, (22)
– ионная
сила раствора, (22)
где mi – концентрация i-го иона в молях/литр, а zi – заряд иона в электронных единицах. Для 1,1 – валентного электролита zi = 1. При расчете ионной силы учитывают все ионы, находящиеся в растворе.
Обычно степень диссоциации определяется не в воде, а в буферном растворе с известным значением рН. Тогда уравнение (20) можно записать в виде
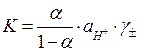 |
(23)
Степень диссоциации 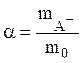 находят
по спектрофотометрическим данным. Логарифмируя (23) и учитывая, что
рН = – lg aН+, имеем
находят
по спектрофотометрическим данным. Логарифмируя (23) и учитывая, что
рН = – lg aН+, имеем
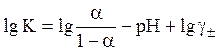 (24)
(24)
Поскольку pKa = – lgKa, приходим к следующему уравнению
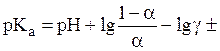 (25)
(25)
С-1. Определение константы ионизации цитидина
спектрофотометрическим методом
Цитидин является одним из нуклеозидов, входящих в состав рибонуклеиновых кислот. Он состоит из гетероциклического основания – цитозина, соединенного N-гликозидной связью с углеводным остатком рибозы. В водных растворах цитидин (В) протонируется с образованием формы ВН+, что приводит к диссоциации по схеме:
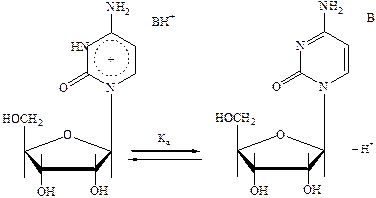
где 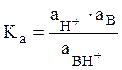 –
термодинамическая константа ионизации.
–
термодинамическая константа ионизации.
От способности нуклеозидов к ионизации зависят их химические и физические свойства, в частности, реакционная способность. Протонирование оснований влияет также на вторичную структуру нуклеиновых кислот и полинуклеотидов.
В настоящей работе ионизация цитидина изучается спектрофотометрическим методом, позволяющим работать с незначительным количеством изучаемого вещества. Значения a находят путем измерений оптической плотности D в содержащих цитидин буферных растворах с известным значением рН, а также величин оптической плотности кислого и щелочного растворов цитидина:
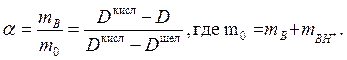 (26)
(26)
Приборы и реактивы
1. Спектрофотометр.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.