Как видно из таблицы (см. ниже), в ряду глицин, аланин, валин происходит увеличение размера углеводородного радикала, что повышает их растворимость в подвижной органической фазе, а значит, вызывает и увеличение a.
Из уравнения скорости движения хроматографической зоны (9) следует, что в этом ряду будет увеличиваться и скорость движения вещества при хроматографии, т. е. возрастать величина Rf (12). Это и наблюдается в действительности. Увеличение длины гидрофобного радикала в аминокислотах приводит к увеличению их Rf.
Наличие же полярных групп (–NH2, –COOH и др.) снижает величину Rf, т. к. увеличивается растворимость в неподвижной водной фазе. Так, аспарагиновая кислота, отличающаяся от аланина только присутствием карбоксильной группы, имеет значительно меньшую величину Rf.
|
Аминокислота |
Rf в системе фенол-вода (8 : 2) |
|
|
0,42 |
|
|
0,59 |
|
|
0,75 |
|
|
0,32 |
Скорость движения и степень разделения аминокислот зависят не только от их строения, но и от свойств применяемой подвижной органической фазы, в качестве которой чаще всего используют фенолы, спирты, кетоны. С увеличением полярности подвижной фазы возрастает подвижность веществ при хроматографии. При разделении аминокислот используют верхний органический слой системы н-бутанол-уксусная кислота-вода (4 : 1: 5), в котором содержатся, наряду с бутанолом, равновесные количества воды и бутилацетата.
Для обнаружения пятен аминокислот на хроматограмме применяют цветную реакцию на аминогруппу с нингидрином. Аналогичное окрашивание дают не только аминокислоты, но и восстановители и аммиак, а также пептиды, белки, первичные алифатические амины, аминосахара и производные аминокислот. Реакция с нингидрином быстрее протекает при повышении температуры.
Экспериментальная часть
Лист бумаги 550 х 150 мм размечают, как показано на рисунке (см. ниже) (линию фронта отмечать не надо). Места нанесения веществ на линии старта отмечают и подписывают карандашом.
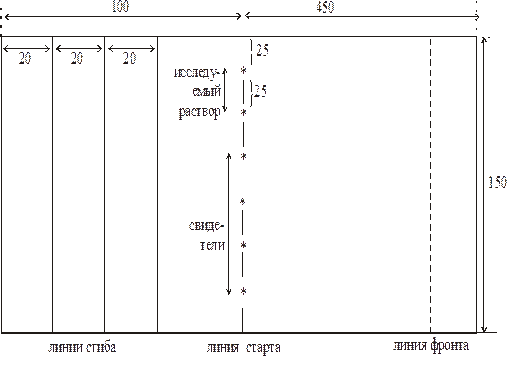
Исследуемый раствор и растворы свидетелей тремя касаниями наносят на линию старта при помощи капилляров в виде пятен диаметром не более 7 мм. Оптимальное количество отдельной аминокислоты в смеси составляет 1-5 мг. Пятна высушивают на воздухе при комнатной температуре.
Сгибают лист по линиям сгиба и заправляют его в лодочку, в которую затем наливают систему растворителей, используемую в качестве подвижной фазы. Лодочка должна быть наполнена на 3/4 объема. На дно камеры наливают слой системы, используемой для разделения, в целях создания насыщенной атмосферы. Камера должна быть герметичной.
Хроматография длится 12-18 часов, поэтому последующие процедуры лучше перенести на другой день.
Хроматограмму осторожно вынимают из лодочки (так, чтобы растворитель из лодочки на нее не пролился) и высушивают на воздухе. Затем проводят опрыскивание хроматограммы раствором нингидрина в этаноле для обнаружения пятен. Бумага должна быть основательно пропитана проявляющим раствором, однако не настолько, чтобы произошло размывание пятен.
Затем хроматограмму помещают в сушильный шкаф и выдерживают при 50-60°С в течение 15-20 минут. Аминокислоты проявляются в виде окрашенных пятен. В отчете нужно указать, какие аминокислоты присутствовали в исследуемой смеси, отметить цвет и интенсивность окраски пятен после реакции с нингидрином, а также рассчитать значения Rf по уравнению (13) для каждого пятна.
Х-2. Разделение смеси аденозин-5'-монофосфата (АМP),
аденозин-5'-дифосфата (АDP) и аденозин-5'-трифосфата (АТP) методом хроматографии на DEAE-бумаге
Приборы и реактивы
1. Камера для хроматографии.
2. DEAE-бумага DЕ-81, 140 х 70 мм.
3. Капилляры для нанесения растворов веществ.
4. Линейка и карандаш.
5. Ультрахемископ.
6. 3%-ные водные растворы натриевых солей АМP, АDP и АТP.
7. Буферный раствор: 4М муравьиная кислота – 0,1 M формиат аммония, рН=1,8
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.