Поглощение света сильно зависит как от природы вещества, так и от длины волны. Зависимость поглощения от длины волны l светового потока называется спектром поглощения. Области (выраженные в единицах длины волны) интенсивного поглощения называются полосами или линиями поглощения.
Различают следующие спектральные области:
Вакуумного ультрафиолета: l = 60–200 нм
Ультрафиолетового спектра: l = 200–380 нм
Спектра в видимой области: l = 380–750 нм
Инфракрасных спектров: l = 750–105 нм
Микроволновых спектров: l = 105–108 нм
Поглощение света связано с переходом молекулы из основного состояния в возбужденное:
![]()
Согласно квантовой механике, такие переходы осуществляются скачкообразно, причем величина поглощенного кванта hn равна разности энергий возбужденного и основного состояний молекулы
hn = Eвозб – Еосн , (1)
где h – постоянная
Планка, 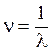 – частота, λ – длина волны.
– частота, λ – длина волны.
Поглощение кванта света с высокой частотой (энергии перехода 100–10 ккал/моль) вызывает в молекуле электронные переходы. Соответствующие спектры в видимой и ультрафиолетовой области называются электронными.
Инфракрасные спектры отвечают колебательно-вращательным переходам (энергии перехода 10–0,1 ккал/моль).
Микроволновые спектры отвечают низшим энергетическим молекулярным переходам – вращательным (энергии перехода 0,1–0,01 ккал/моль).
Излучение еще большей длины волны (радиочастоты с длиной волны более 1 м) уже не вызывает внутримолекулярных переходов; поглощение энергии в этом диапазоне связано с движением молекул и молекулярных систем.
На электронные спектры частиц в растворах сильно влияют межмолекулярные взаимодействия частицы с растворителем, что ведет к уширению полос и их смещению. Полосы поглощения характеризуют значениями lмах – это длина волны, отвечающая максимальному поглощению для данной полосы. На рис.1 в качестве примера показан спектр поглощения дифенила (С6Н5)2 в области 215–300 нм. Здесь lмах = 252 нм.
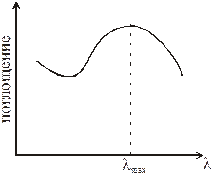
Рис.1
В настоящее время известно, что все молекулы способны поглощать кванты с энергией 50–200 ккал/моль. Это ведет к электронным переходам и даже к отрыву электрона или разрыву связей в молекуле. Однако далеко не все молекулы могут поглощать в видимой и тем более в ультрафиолетовой областях спектра. Для того чтобы молекула могла поглощать в этой области, надо облегчить электронные переходы. Уменьшение энергии кванта DЕ ведет к сдвигу полосы поглощения в длинноволновую область, поскольку
![]() , (2)
, (2)
где с – скорость света в вакууме.
Уменьшению энергии электронных переходов способствует наличие в молекуле цепи сопряженных связей – С = С – С = С – , ароматических колец и хромофорных групп, например, нитрогруппы – NO2, карбоксильной – СООН, карбамидной – СОNН2, азометиновой > C = N –, азогруппы – N = N – и других. Хромофорные группы сообщают «окраску» молекуле, с которой они связаны. Окраску усиливают (углубляют) так называемые ауксохромные группы, например, оксигруппа – ОН, аминогруппа –NH2, которые сами по себе в этой области «прозрачны».
Наличие в молекуле большого числа взаимодействующих между собой p-электронов и неподеленных пар электронов снижает величину кванта энергии, необходимую для перевода молекулы в первое возбужденное состояние.
1.3. Принципиальная схема спектрофотометра
Свет от источника А (рис.2) через щель Б попадает на призму В и разлагается в спектр Г. Щель Д «вырезает» полосу Dl с длиной волны l. Луч проходит кювету с исследуемым раствором Е. Выходящий из кюветы поток попадает на катод фотоэлемента Ж, вырывая из него электроны. К аноду фотоэлемента приложен положительный потенциал батареи З. Возникающий в цепи ток фиксируется с помощью усилителя и гальванометра И. В простейшем случае отклонение стрелки гальванометра является мерой интенсивности светового потока, прошедшего через кювету.
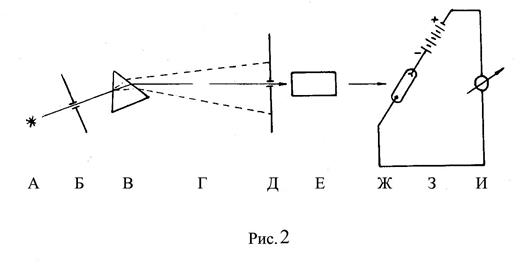
Устройство современного спектрофотометра гораздо сложнее как в отношении оптической и фотоэлектрической частей прибора, так и в отношении процедуры измерений.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.