Далее, усреднив полученную серию
результатов, найти ![]() и
и ![]() . Окончательный
результат представить в виде
. Окончательный
результат представить в виде ![]() ± D
± D![]() , где D
, где D![]() – наибольшее
отклонение в серии значений
– наибольшее
отклонение в серии значений ![]() от средней величины, или разброс этой величины.
от средней величины, или разброс этой величины.
Рассчитать ионную силу раствора в средней
точке титрования по формуле (18). Внеся поправку на коэффициент активности
согласно (24), определить ![]() и термодинамическую
константу ионизации карбоксильной группы глицина (К1).
и термодинамическую
константу ионизации карбоксильной группы глицина (К1).
Протолитическое равновесие глицина можно представить в виде следующей схемы:
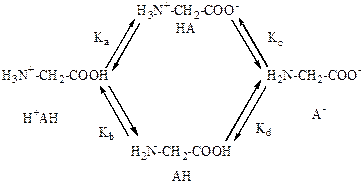
Эта схема описывает ионизацию при помощи четырех промежуточных констант (микроконстант) Кa, Кb, Кc и Кd, каждая из которых соответствует одному из четырех процессов ионизации в системе. Константы связаны между собой соотношением Кa × Кc= Кb ×Кd. Наблюдаемые на опыте константы ионизации К1 и K2 связаны с промежуточными константами:
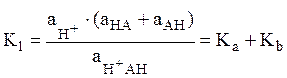 ,
,
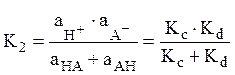 .
.
Поскольку мы имеем три независимые промежуточные константы и только две константы, измеряемые на опыте (К1 и К2), последних недостаточно для определения первых.
Однако величина Кb может быть оценена, исходя из константы ионизации гидрохлорида метилового эфира глицина. Для определения Кb предлагается студентам самостоятельно запланировать и провести эксперимент по потенциометрическому титрованию гидрохлорида метилового эфира глицина. Определив Kb экспериментально, далее следует рассчитать:
![]()
Kc =K2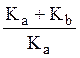
Kd = 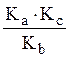
Не зависящее от рН отношение между концентрациями цвиттерионной и незаряженной форм молекул глицина определить из отношения Кa/Кb:
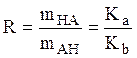 .
.
Полученные значения К1, К2 и R сравнить с литературными.
3. КИНЕТИКА
3.1. Основные понятия кинетики
В работах по кинетике встречается много специальных понятий и терминов. Некоторые из них обсуждаются ниже.
Пусть в реакцию вступают n1 молекул типа А1, n2 молекул типа А2, nn молекул типа An. При этом продуктами реакции являются n1¢ молекул типа В1, n2¢ молекул типа В2, nk¢ молекул типа Вk. Тогда этот химический процесс можно записать так:
n1А1 + n2А2 + …. + nnАn ® n1¢B1 + n2¢B2 + …. + nk¢ Bk. (1)
Это стехиометрическое уравнение реакции, а числа ni, ni¢ называются стехиометрическими коэффициентами.
Реакция называется простой (или элементарной) химической реакцией, если она протекает в одну стадию, т.е. при одновременном взаимодействии n1 + n2 + …+ nn = n молекул.
Реакции, протекающие в несколько стадий, называются сложными. Совокупность стадий, из которых складывается реакция, называется механизмом или схемой химической реакции.
Элементарный акт – простейшая реакция (стадия сложного процесса), представляющая прямой переход исходных частиц в конечные (промежуточные) за счет перегруппировки атомов внутри молекулы или при столкновении двух-трех частиц.
Молекулярность – число молекул, участвующих в элементарном акте реакции. Различают моно-, би- и тримолекулярные реакции.
Скорость химической реакции по некоторому компоненту – это изменение числа молей этого компонента N в единицу времени в единице объема V. При постоянном объеме она выражается как:
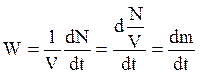 ,
,
где m – концентрация вещества.
Скорости реакции по отдельным компонентам связаны между собой следующим образом:
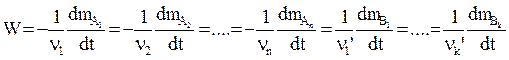
(заметим, что если вещество расходуется в реакции, скорость записывается со знаком минус, если вещество образуется, скорость записывается со знаком плюс).
Действительно, для реакции взаимодействия окиси азота с хлором:
2 NO + Cl2 ® 2 NOCl
концентрация окиси азота изменяется в два раза быстрее, чем концентрация хлора, т.к. на каждую израсходованную молекулу хлора расходуется две молекулы NO.
Зависимость скорости реакции от концентрации исходных веществ выражается законом действия масс:
![]()
Эта формула носит также название кинетического уравнения реакции.
Числа n1, n2 … – порядки реакции по компонентам А1, А2, … . Сумму порядков по всем реагирующим веществам называют порядком реакции. Коэффициент k называется константой скорости реакции.
Для простой реакции, протекающей по стехиометрическому уравнению (1) скорость:
![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.