где a – найденный угол вращения для исходного раствора сахарозы; [a] – удельный угол вращения сахарозы (равен +66,55°); L – длина трубки в дециметрах (измерить самостоятельно).
2. Определение угла вращения реакционной смеси в нулевой момент времени реакции.
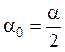
где a – угол вращения исходного раствора сахарозы (в реакционной смеси
раствор сахарозы вдвое разбавлен соляной кислотой). Величина ![]() практически не зависит от температуры.
практически не зависит от температуры.
3. На основании экспериментальных данных строят кинетические кривые в координатах at – t[сек].
4. Рассчитывают константы скорости реакции для данных температур, считая ее реакцией псевдопервого порядка, по формуле:
k = (1/t) ln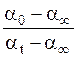 .
.
Для этого заполняют таблицу:
|
t |
at |
at-a¥ |
|
1/t |
ln |
k |
По полученным значениям k находят среднюю величину константы скорости реакции при каждой температуре kср.ариф.
Константу скорости реакции находят также
графически, строя зависимость ln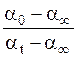 – t[сек.]. В
этом случае kгр. =tgb, где b – угол наклона прямой по отношению к
абсциссе. Находят относительную ошибку между рассчитанным значением kср.ариф. и найденным графически.
– t[сек.]. В
этом случае kгр. =tgb, где b – угол наклона прямой по отношению к
абсциссе. Находят относительную ошибку между рассчитанным значением kср.ариф. и найденным графически.
5. Определение энергии активации.
Строят графическую зависимость, откладывая
на оси абсцисс ![]() , а на оси ординат – ln kср.ариф.. Тангенс угла наклона прямой в этих
координатах дает значение
, а на оси ординат – ln kср.ариф.. Тангенс угла наклона прямой в этих
координатах дает значение ![]() , т.е. Еакт.
= Rtgb.
, т.е. Еакт.
= Rtgb.
К-2. Кинетика гидролиза п-нитрофенилфосфата
щелочной фосфатазой
1. Термостат (30°С).
2. Секундомер.
3. Фотоэлектроколориметр (ФЭК).
4. Пробирки.
5. Пипетки на 1; 2; 5 и 10 мл.
6. Ванночка со льдом для хранения раствора фермента.
7. 0,02 М раствор NаОН.
8. Раствор фермента с активностью 0,1 ФE/мл.
9. 0,05 М глициновый буфер, рН=10, содержащий 5×10-4 М MgSO4 (раствор В).
10. 0,01 M раствор n-нитрофенилфосфата в 0,05 М глициновом буфере, рН=10, содержащем 5×10-4 М MgSO4 (раствор А).
Щелочная фосфатаза катализирует гидролиз сложноэфирной связи в фосфомоноэфирах. Одним из субстратов этого фермента является n-нитрофенилфосфат, который гидролизуется по схеме:
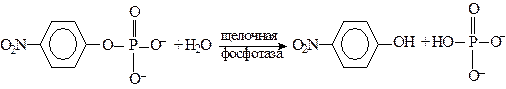
Образующийся в результате реакции n-нитрофенол поглощает свет в видимой области спектра (405-420 нм), что позволяет определять кинетические параметры (Кm и Vmax) этой реакции колориметрическим методом.
Экспериментальная часть
а) Приготовление рабочих растворов субстрата
Для опытов приготовить рабочие растворы, содержащие 0,05 М глициновый буфер, рН=10 и 5×10-4 М MgSO4 со следующими концентрациями n-нитрофенилфосфата: (1) 0,01M (раствор А); (2) 0,005 М; (3) 0,003 М; (4) 0,001 M; (5) 0,0005 М.
Рабочие растворы (2)-(5) следует готовить, исходя из раствора А (0,01 M n-нитрофенилфосфат в 0,05 М глициновом буфере, рН=10, содержащем 5×10-4 М MgSO4), разбавляя его раствором В (0,05 М глицинового буфера, рН=10, содержащего 5×10-4 М MgSO4). Объем каждого рабочего раствора должен составлять 5 мл.
б) Процедура измерения скорости гидролиза п-нитрофенилфосфата
1. В пробирку налить 4,5 мл рабочего раствора (1) и, пока он прогревается до температуры термостата (30°С), приготовить 4 пробирки с 9 мл 0,02 М раствора NaOH в каждой.
2. Далее в реакционную смесь внести 0,5 мл раствора фермента, перемешать, одновременно включив секундомер.
3. Через 2, 5, 10 и 15 мин от начала реакции из реакционной смеси отобрать пробы по 1 мл, быстро вылить их в пробирки с 0,02М раствором NаОН и тщательно перемешать. Приготовить контрольный раствор, содержащий 0,5 мл рабочего раствора (1) и 4,5 мл 0,02М NaOH
4. Замерить оптическую плотность каждой отобранной пробы на ФЭКе в 1 см кюветах при 400 нм против контрольного раствора.
Проделать описанный выше эксперимент для каждого рабочего раствора (2), (3), (4) и (5).
Щелочную фосфатазу в процессе работы хранить в ледяной бане.
Результаты кинетических измерений занести в таблицу:
|
Концентрация субстрата |
tмин. |
D400 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.