Порядок реакции по веществу Ai равен соответствующему стехиометрическому коэффициенту ni.
В случае сложной реакции порядок реакции по реагирующему веществу не обязан быть равным соответствующему стехиометрическому коэффициенту, и может принимать как целочисленные, так и дробные значения.
Константа скорости k показывает, с какой скоростью идет реакция. Константа k зависит от температуры. В большинстве случаев эту зависимость можно описать уравнением Аррениуса:
![]()
где А – предэкспонента, ЕА – энергия активации, R – универсальная газовая постоянная, Т – абсолютная температура (по шкале Кельвина).
Для реакций в растворах, как правило, ЕА = 10 ё 30 ккал/моль. В случае мономолекулярных реакций А имеет смысл частоты колебаний по разрываемой связи, причем А ~ 1013 сек–1. В случае бимолекулярных реакций А пропорционально числу соударений двух молекул.
Для определения энергии активации исследуют зависимость k от температуры. Наклон прямой в координатах ln k –1/T paвен EA/R. Отсюда находят EA, и далее по уравнению Аррениуса можно найти ln A. Значения ЕА и ln A не зависит от температуры.
Глубина реакции – разность между исходной и текущей концентрацией одного из реагентов. С помощью соотношений баланса можно выразить концентрацию каждого компонента через глубину. Вводя глубину х для реакции
А + 2В ® С
![]()
![]()
![]()
находим кинетическое уравнение:
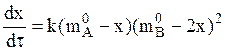
Реакцию называют необратимой, если она в условиях опыта
проходит практически до конца. Подчеркивая необратимость, вместо знака
равенства ставят стрелку слева направо. Когда наряду с прямой реакцией
протекает обратная (справа налево), реакцию в целом называют обратимой.
Обратимые реакции не доходят до конца, в системе устанавливается равновесие.
Если фиксируют внимание на обратимости, вместо знака равенства ставят две
стрелки, например, ![]() .
.
Иногда бимолекулярная реакция А + В ® С описывается уравнением первого порядка:
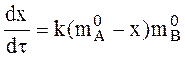 =
= ![]() .
.
Это случается, если вещество В взято в большом избытке и mB в ходе опыта не меняется. Такие реакции называют реакциями псевдопервого порядка.
Таким образом, не существует общей простой связи между стехиометрическими коэффициентами, порядком реакции и её молекулярностью. Определение порядка реакции еще не достаточно для выяснения её истинной молекулярности.
Для исследования кинетики реакций в растворах можно использовать, например, метод отбора проб, когда из реакционного сосуда пипеткой через определенные интервалы времени отбирают пробы. Для быстрого прекращения реакции пробы выливают в охлажденный растворитель или специальный раствор, который взаимодействует с одним из реагентов. Затем пробы анализируют и по полученным данным находят зависимость глубины превращения от времени.
Другие методы предусматривают слежение за изменением состояния реакционной системы по какому-либо суммарному физико-химическому свойству системы, зависящему от глубины реакции. Такие методы позволяют изучать кинетику непосредственно в реакционном сосуде.
Если исходные вещества или продукты реакции поглощают свет в ультрафиолетовой или видимой области спектра, применяется спектрофотометрический метод. Оптическая плотность раствора линейно зависит от концентрации поглощающих частиц и по ее изменению можно судить о ходе реакции.
В принципе, любой количественный аналитический или физический метод может быть использован с этой целью.
3.2. Кинетика необратимых реакций 1го порядка.
Кинетическое уравнение для необратимой реакции 1го порядка
А ® В
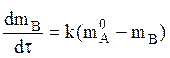
интегрируется
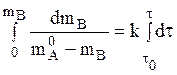
Имеем
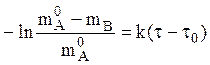 ,
,
Отсюда
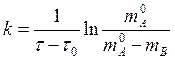
Измеряя текущую концентрацию продукта В (mB) и зная начальную концентрацию А, находят ряд значений k. Если реакция действительно первого порядка, все значения k в данном опыте будут равны. Так можно не только определить k, но и проверить корректность кинетического уравнения.
3.3. Кинетика ферментативных реакций
Большой вклад в теорию действия ферментов внесли Л. Михаэлис и М. Ментен. Они постулировали, что фермент Е сначала обратимо связывает субстрат с образованием фермент-субстратного комплекса ES, который далее необратимо превращается в продукт реакции Р с освобождением молекулы фермента:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.