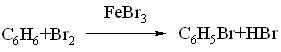
б) отношение бензола к действию окислителей
В пробирку наливают ~1-2 мл бензола и ~2 мл подкисленного водного раствора перманганата калия и энергично взбалтывают содержимое. Окраска не изменяется даже при нагревании, что указывает на устойчивость бензольного кольца к окислителям.
в) горение бензола
При поджигании бензол горит коптящим пламенем:
C6H6 + 7,5 O2 ® 6CO2 + 3H2O
Реактивы:
Скипидар
Бромная вода
Раствор перманганата калия
Ход работы:
а) взаимодействие скипидара с бромом
В пробирку наливают ~2-3 мл бромной воды и ~0,5 мл живичного скипидара. При встряхивании происходит обесцвечивание вследствие присоединения брома к a-пинену (основному компоненту скипидара) по месту разрыва двойной углерод-углеродной связи.

б) окисление a-пинена
В пробирку наливают ~0,5 мл скипидара и 1-2 капли раствора перманганата калия. При встряхивании наблюдается обесцвечивание перманганата калия вследствие окисления a-пинена.
Реактивы:
Смесь этанола и концентрированной серной кислоты (1:1)
Хлорид натрия (поваренная соль)
Ход работы:
Хлористый этил получается из этилового спирта и хлористого водорода, образующегося из хлорида натрия в присутствии концентрированной серной кислоты:
NaCl + H2S04 ® NaHSO4 + HСl
C2H5-OH + HСl ® H2O + C2H5-Cl
Эта реакция является частным случаем замены гидроксила на галоген. В сухую пробирку насыпают ~1 г хлорида натрия, приливают ~1 мл этилового спирта и ~1мл концентрированной серной кислоты. Пробирку зажимают держателем, вставляют газоотводную трубку и осторожно нагревают на пламени спиртовки. Конец газоотводной трубки помещают в пламя второй спиртовки. Хлористый этил, выделяющийся из газоотводной трубки, горит светящимся пламенем зеленого цвета, что характерно для галогенпроизводных.
Реактивы:
Иод
Вода
Этанол
Раствор гидроксида натрия
Ход работы:
В пробирку помещают ~0,5 г иода, ~0,5 мл этилового спирта и 3-4 мл воды. Образовавшуюся смесь энергично встряхивают, нагревают на водяной бане до ~700 С, а затем к ней по каплям приливают разбавленный (~10%-ный) раствор гидроксида натрия до исчезновения бурой окраски иода. Через несколько минут выпадает желтый осадок иодоформа, который легко узнать по характерному запаху. Реакция протекает по следующим схемам:
взаимодействие иода со щелочью
I2 + 2NaOH ® H2O + NaI + NaOI
окисление спирта в альдегид
CH3CH2OH + NaOI ® CH3CHO + NaI +H2O
замещение атомов водорода в радикале альдегида на атомы иода
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.