В равновесном состоянии температуры систем равны. Из (12.15), (12.16) и (12.12) следует, что при диффузионном контакте двух систем в равновесном состоянии выравниваются частные производные от энтропии по числу частиц:
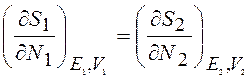 (12.17)
(12.17)
Чтобы обсудить это равенство, рассмотрим два способа изменения энергии системы. При тепловом контакте изменение энергии системы равно количеству тепловой энергии, передаваемой системе при обратимом равновесном процессе:
dE=dQ=TdS (12.18)
В случае диффузионного контакта изменение энергии системы происходит при диффузии частиц. Работа, совершаемая над системой в результате диффузии, называется химической работой. Тогда увеличение энергии системы
dE=dA=mdN (12.19)
Коэффициент m, называется химическим потенциалом и равен работе при диффузии одной частицы. Изменение энергии при тепловом и диффузионном контактах
dE=TdS+mdN. (12.20)
Изменение энтропии системы
![]() .
(12.21 )
.
(12.21 )
Сравнив (12.21) и (12.16), видим, что
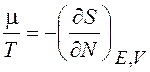 (12.22)
(12.22)
Из (12.22) видно, что в состоянии равновесия равны не только температуры, но и химические потенциалы двух систем, находящихся в диффузионном контакте:
m1=m2 (12.23)
Если сначала T1 = T2 и m1>m2, то частицы будут перемещаться из системы 1 в систему 2. Покажем это. Учитывая, что dN1=-dN2и dE1=-dE2, запишем изменение энтропии
![]() (12.24)
(12.24)
Поскольку система стремится к равновесному состоянию, энтропия системы возрастает и при m1>m2. Значит, частицы перемещаются из системы 1 с высоким значением химического потенциала в систему 2 с низким его значением. Системы с большей концентрацией частиц имеют больший химический потенциал, чем системы с низкой их концентрацией. Поэтому частицы стремятся диффундировать из областей с высокой концентрацией в области с низкой концентрацией.
Химический потенциал служит мерой зависимости числа доступных состояний от числа частиц в системе.
§ 12.4 "Механический" контакт двух систем.
Уравнение состояние идеального газа
Рассмотрим "механический" контакт двух систем, состоящих атомов идеального газа. Системы разделены поршнем, способным перемещаться без трения (рис. 12.3). В равновесном состоянии энтропия изолированной системы максимальна, поэтому выполняются соотношения
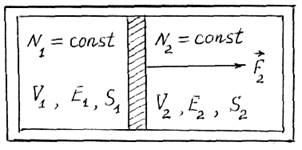 dS1= – dS2 .(12.25)
dS1= – dS2 .(12.25)
Если результирующая сила ![]() переметает
поршень на dx, то изменение энергии системы 2
переметает
поршень на dx, то изменение энергии системы 2
dE¢2=F2dx=-P2dV2 , (12.26)
|
где Р2 – давление идеального газа в системе 2.
Знак "минус" учитывает уменьшение объема dV2<0. Изменение энтропии системы зависит не только от энергии, но и от объема системы
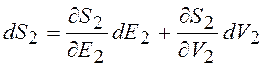 . (12.27)
. (12.27)
Изменение энергии системы в этом случае
![]() . (12.28)
. (12.28)
Отсюда
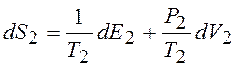 . (12.29)
. (12.29)
Из сравнения (12.29) с (12.27) следует
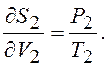 (12.30)
(12.30)
Из (12.25) следует, что в равновсном состоянии выравниваются не только температуры, но и частные производные от энтропии по объёму, а следовательно и давление идеального газа в системах
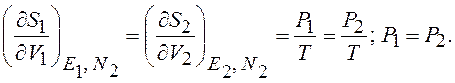 (12.31)
(12.31)
Из соотношения (12.30) легко получить уравнение состояния идельного газа. Для этого необходимо определить производную ¶S/¶V при N=const. Представим энтропию системы в виде суммы
S = Su = k lnWu(12.33)
Пространственная составляющая статвеса для Nчастиц идеального газа, распределенных по ячейкам
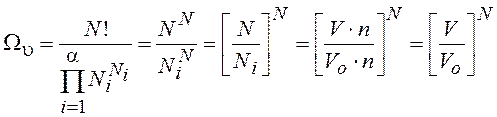 , (12.35)
, (12.35)
где V0 – объём ячейки; n – концентрация частиц.
Подставим (12.35) в (12.33):
S = kN ln V – kn ln V0 (12.36)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.