W=ПWI (12.1)
Соответственно энтропия системы, находящейся в равновесном состоянии,
![]() (12.2)
(12.2)
§ 12.2. Тепловой контакт двух систем. Определение энтропии и температуры
|
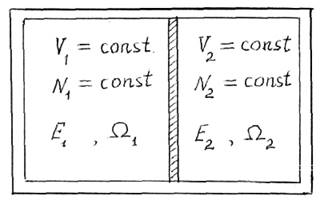
Рис. 12.1
Изолированной системой называется система с постоянной энергией, постоянным числом частиц, находящихся в постоянном объеме;
E=E1+E2=const N=N1+N2=const V=V1+V2=const(12.3)
Статвес равновесной системы
W=W1+W2 (12.4)
Частицы, ударяясь о перегородку, передают энергию из одной системы в другую. Изменения энергий систем равны и противоположны по знаку
dE1=-dE2 (12.5)
В равновесном состоянии статвес системы максимален. Тогда
W1dW2+W2dW1=0 (12.6)
Разделим (12.6) на W1W2
dW1/W1 = -dW2/W2; dlnW1=-dlnW2 (12.7)
Из (12.7) видно, что относительное изменение статвеса, равное изменению логарифма статвеса, однозначно характеризует изменение состояния системы, поэтому lnW можно выбрать в качестве аддитивной функции состояния системы, не зависящей от предыстории состояния системы:
S = lnW. (12.8)
Энтропия служит мерой беспорядка в системе. Для изолированной равновесной системы энтропия максимальна. Тогда изменение энтропии равно нулю
dS=dS1+dS2=0; dS1=-dS2. (12.9)
Поскольку при тепловом контакте энтропия зависит от энергии, преобразуем (12.9) следующим образом:
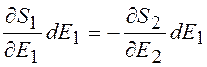 (12.11)
(12.11)
Заменим dE2= – dE1:
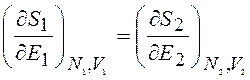 (12.11)
(12.11)
Из (12.11) видно, что в состоянии равновесия систем при тепловом контакте двух систем выравниваются производные от энтропии по энергии при постоянном объеме и неизменном числе частиц каждой из систем. Эти производные можно выбрать в качестве интенсивного параметра, характеризующего равновесие системы. Величина, обратная частной производной от энтропии по энергии, называется температурой системы
![]() (12.12)
(12.12)
При таком определении температура измеряется в джоулях либо в электровольтах (1 эВ = 1,6×10-19 Дж).
Отношение температуры в джоулях к температуре в градусах по шкале Кельвина k = 1.38×10-23 Дж/К и называется постоянной Больцмана. Перейдем от безразмерной энтропии(12.8) к размерной
S º k lnW (12.13)
Тогда температура, определяемая (12.12), выразится в градусах Кельвина, или просто в Кельвинах. В состоянии равновесия температуры двух систем выравниваются:
T1=T2. (12.14)
Температура является интенсивным параметром системы, не зависящим от объема, энергии и числа частиц, заключенных в ней.
§ 12.3. Диффузионный контакт двух систем.
Определение химического потенциала
|
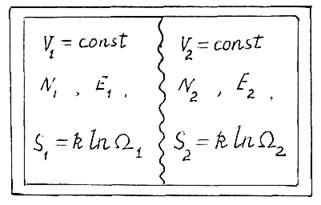 Рассмотрим изолированную систему N частиц, состоящую, в
свою очередь, из двух систем, разделенных пористой перегородкой, диффузионный
контакт происходит при переходе атомов через перегородку. При этом системы
обмениваются частицами и энергией (рис.12.2). В равновесной системе энтропия
максимальна и выполняются следующие соотношения:
Рассмотрим изолированную систему N частиц, состоящую, в
свою очередь, из двух систем, разделенных пористой перегородкой, диффузионный
контакт происходит при переходе атомов через перегородку. При этом системы
обмениваются частицами и энергией (рис.12.2). В равновесной системе энтропия
максимальна и выполняются следующие соотношения:
dS1= – dS2; dN1= – dN2; dE1= – dE2; (12.15)
Энтропия системы является функцией энергии и числа частиц при постоянном объеме. Тогда изменения энтропии систем
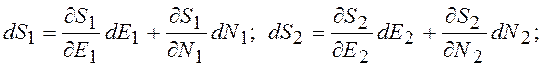 (12.16)
(12.16)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.