Рассмотрим зависимость W от xпри х <<N. Воспользуемся приближением e±x/N = 1 ± x/N. Тогда
![]() (13.39)
(13.39)
Из (13.39) видно, что при х = 0 статвес имеет резкий максимум. Соответственно энтропия подсистемы
S=k×(2N×ln 2 – 2x2/N) (13.40)
При х = 0, когда N1 = N2, Smax. = k×2N×ln 2.
Применяя распределение Больцмана для двухуровневой системы, запишем
![]() , (13.41)
, (13.41)
![]() (13.42)
(13.42)
Отношение N2/N1 называется отношением населенностей уровней энергии. Когда N2>N1, населенность уровней называется инверсной.
При N2>N1, Т < 0. Отрицательная температура является температурой перехода и не характеризует термодинамическое равновесие всей системы с окружающей средой.
При N2=N1 температура перехода Т = ± ¥.
Реально молекулы характеризуются поступательными, колебательными и вращательными степенями свободы и температура системы положительна.
§ 13.5. Распределение Максвелла
Рассмотрим систему N атомов идеального газа в закрытом сосуде. В результате столкновений атомов между собой и со стенками сосуда устанавливается такое статистическое распределение атомов по скоростям, импульсам и энергиям, которое в силу принципа детального равновесия не будет меняться при дальнейших столкновениях. В состоянии статистического равновесия идеального газа с сосудом энтропия системы максимальна при условиях N= const, Е= const.
Для фиксированных значений импульсов распределение Больцмана (13.43)
Однако в результате столкновений импульсы атомов изменяются непрерывно. Рассмотрим дифференциальный объем 4pp2dp в пространстве импульсов (рис.13.3). Доля атомов, импульсы которых оканчиваются в пределах от р до р + dp пропорциональна 4pp2dp
![]() (13.44)
(13.44)
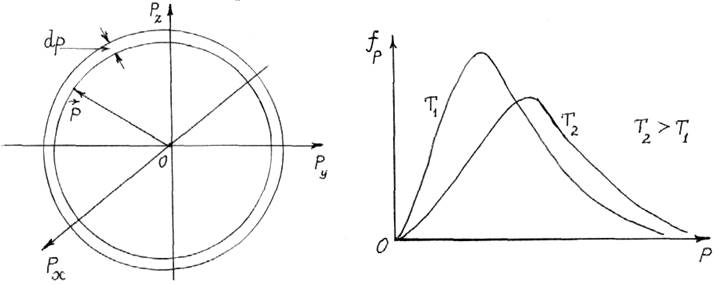
Рис. 13.3 Рис. 13.4
Функция распределения атомов по импульсам (функция Максвелла) (рис.13.4)
![]() (13.45)
(13.45)
Из условия нормировки 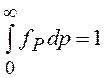 находим
А:
находим
А:
А = (2pmkT)-3/2. (13.46)
Заменяя в (13.45) р = mu, получаем функцию распределения молекул по скоростям (рис.13.5)
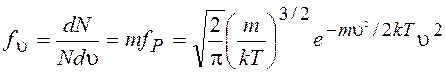 (13.47)
(13.47)
Заменяя р2/2m = E, получаем распределение атомов по кинетическим энергиям (рис. 13.6)
![]() (13.48)
(13.48)
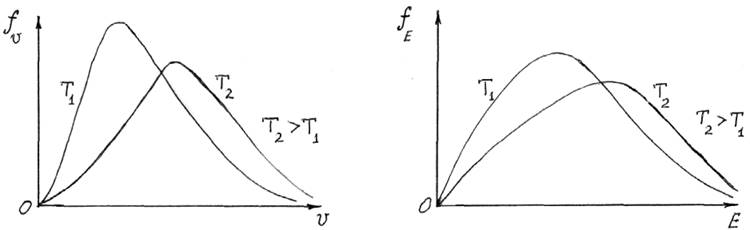
Рис. 13.5 Рис. 13.6
Средняя арифметическая скорость атомов (молекул)
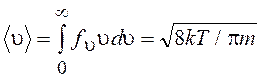 (13.49)
(13.49)
Среднеквадратичную скорость атомов определим из выражения
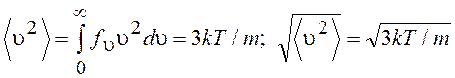 (13.50)
(13.50)
Средняя кинетическая энергия атомов
![]() (13.51)
(13.51)
Наиболее вероятная скорость определяется из условия dfu/du = 0
![]() , (13.52)
, (13.52)
Для молекул, характеризуемых числом степеней свободы i > 3, средняя энергия
![]() (13.53)
(13.53)
Случайные отклонения физических величин от их средних значений называются флуктуациями.
Простейшей мерой флуктуации
величины х служит ее дисперсия sx2 или среднеквадратичное отклонение sx. Величина флуктуации обратно
пропорциональна ![]() . Если число частиц N >> 1, то отклонения физических
величин от средних значений очень малы. Однако флуктуации физических величин
могут существенным образом ограничивать возможности прецизионных измерительных
приборов. Флуктуациями плотности среды обусловлено явление рассеяния света в
различных средах.
. Если число частиц N >> 1, то отклонения физических
величин от средних значений очень малы. Однако флуктуации физических величин
могут существенным образом ограничивать возможности прецизионных измерительных
приборов. Флуктуациями плотности среды обусловлено явление рассеяния света в
различных средах.
1. Построить графики зависимостей вклада одной частицы в энтропию равновесной системы от энергии фотонов при m = 0 и электронов при m = 2 эВ, Т = 300 K.
2. Построить графики функции Ферми при Т = 0 К и Т = 300 К для свободных электронов в металле. Энергию Ферми принять равной 5 эВ.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.