Энергия частицы
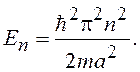 (16.1)
(16.1)
Потенциальная энергия электрона в атоме водорода (рис.16.1)
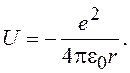 (16.2)
(16.2)
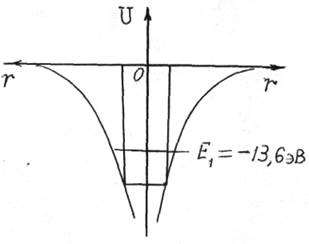
Рис. 16.1
Решение уравнения Шредингера для основного состояния электрона в атоме, водорода имеет вид
![]() r1 = 0.529
r1 = 0.529
![]() . (16.3)
. (16.3)
Энергия электрона в атоме водорода квантована
En = – 13.6 эВ / n2, (16.4)
где n = 1,2,3,…
Заменим потенциальную функцию (16.2) одномерной прямоугольной потенциальной ямой шириной а и высотой U. При сближении двух атомов водорода (рис. 16.2,а) потенциальный барьер между ямами уменьшается и при расстоянии между ядрами атомов, равном а, потенциальный барьер исчезает (рис.16.2,б). При соединении симметричных волновых функций появляется состояние y1, а при соединении симметричной и антисимметричной волновых функций – состояние y2 . При энергии электрона Е << U0 можно применить выражение (16.1) для оценки уровней энергии электрона. Для состояния с n = 1, Е1 = Е0/4. Для состояния n = 2 Е2 << E0. Уровень энергии Е0 , соответствующий одиночной яме, расщепляется на два уровня. В промежуточных случаях при ширине барьера Z, соизмеримой с шириной ямы а, расщепление уровня E0 обусловлено туннельным эффектом – проникновением электрона сквозь барьер (см. § 15.3).
Электроны переходят на уровень энергии E1 << E0/4. В силу принципа Паули спины электронов противоположны. Вероятность нахождения электронов максимальна в центре ямы. В области между ядрами атомов сконцентрировано заряда больше и ядра притягиваются к отрицательному заряду. Связь между атомами, создаваемая двумя электронами, называется ковалентной.
Предоставим читателю самостоятельно рассмотреть последовательные стадии соединения ("сшивания") волновых функций электрона в атоме водорода (16.3). Вероятность нахождения электронов в слое dr для этого случая характеризуется функцией
![]() (16.5)
(16.5)
Перекрытие волновых функций электронов приводит к расщеплению уровней энергии, повышению объемной плотности отрицательного заряда между атомами (рис. 16.3,а) и образованию направленной ковалентной связи между атомами водорода (рис. 16.3,б).
Расщепление уровней энергии при сближении атомов аналогично расщеплению собственных частот двух связанных маятников и контуров, рассмотренных в § 8.4.
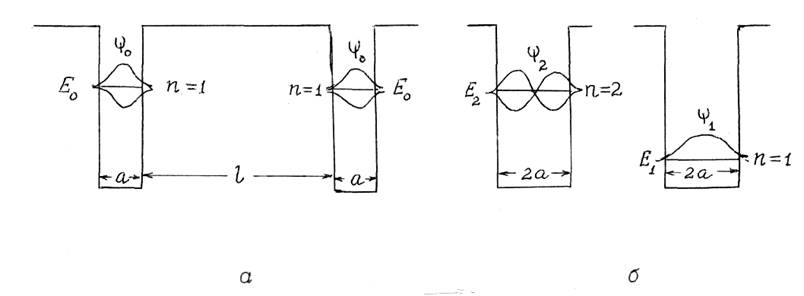
Рис. 16.2
В линейной атомной цепочке в случае сильной связи электрона с атомами уровни энергии атомов расщепляются на подуровни, число которых равно числу атомов в цепочке n (рис.16.4). Так образуются разрешенные энергетические зоны, разделенные запрещенными зонами.
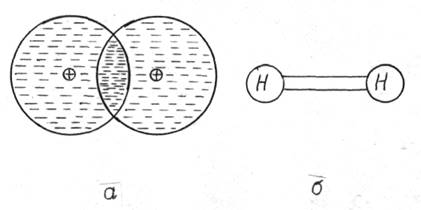
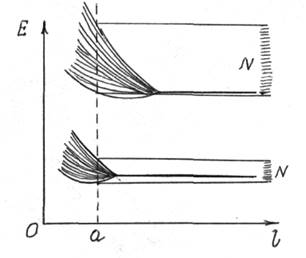
Рис. 16.3 Рис. 16.4
При образовании кристаллов полупроводников, например кремния и германия, волновые функции валентных электронов перекрываются и образуется число состояний, равное числу валентных электронов в кристалле. Соответствующее число энергетических уровней оказывается полностью заполнено валентными электронами при Т = 0 К. Такая зона называется валентной (рис.16.5).
Заметим, что одному уровню энергии соответствует два состояния, которые могут быть заняты не более чем двумя электронами с противоположными спинами.
Пример ковалентной связи между атомами кристалла кремния, являющегося элементом 4-й группы, приведен на рис.16.6. Каждый из четырех валентных электронов атома участвует в ковалентной связи.
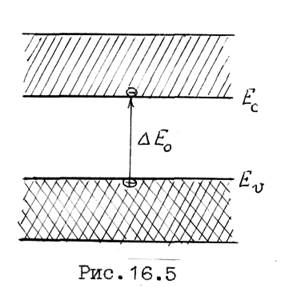
Минимальная энергия, необходимая для разрыва ковалентной связи и перехода электрона из связанного в свободное состояние, называется шириной запрещенной зоны DEg. Потенциальная энергия электрона возрастает на Аи , и электрон под действием внешнего электрического поля может свободно перемещаться в кристалле. Такой электрон находится в зоне проводимости или в свободной зоне.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.