2. Рассмотрим распределение различимых частиц (атомов,
молекул) по энергиям. Пусть имеется изолированная система частиц, в которой
среднее расстояние l между частицами значительно больше длины волны де Бройля, соответствующей
тепловой скорости частицы, т.е. при отсутствии квантового вырождения (l>>h/muT). Такой системой может быть
идеальный газ (воздух при нормальных условиях). Эта система состоит из групп
частиц. Энергия каждой группы E i = N iei, где ei – энергия частицы i-ой группы; Ni – число частиц в группе. Энергия изолированной системы N частиц ![]() постоянна. Число
частиц
постоянна. Число
частиц ![]() . В состоянии равновесия
число частиц в группах в силу принципа детального равновесия остается
неизменным с точностью до флуктуации dNi << Ni. Число частиц в каждой группе Ni >> 1. Каждую группу
частиц можно рассматривать как энергетическую ячейку объемом, равным объему
системы V. Выберем объем системы 7 в качестве объемной ячейки, тем самым
исключим составляющую статвеса, обусловленную обменом частиц между пространственными
ячейками. Частицы не взаимодействуют друг с другом на расстоянии и в основном
движутся свободно, лишь кратковременно взаимодействуя при столкновениях друг с
другом. Число сталкивающихся частиц мало по сравнению с числом свободно
движущихся, поэтому энергия системы состоит из кинетической энергии частиц.
Статвес такой системы равен числу перестановок (переходов) частиц между
энергетическими ячейками системы
. В состоянии равновесия
число частиц в группах в силу принципа детального равновесия остается
неизменным с точностью до флуктуации dNi << Ni. Число частиц в каждой группе Ni >> 1. Каждую группу
частиц можно рассматривать как энергетическую ячейку объемом, равным объему
системы V. Выберем объем системы 7 в качестве объемной ячейки, тем самым
исключим составляющую статвеса, обусловленную обменом частиц между пространственными
ячейками. Частицы не взаимодействуют друг с другом на расстоянии и в основном
движутся свободно, лишь кратковременно взаимодействуя при столкновениях друг с
другом. Число сталкивающихся частиц мало по сравнению с числом свободно
движущихся, поэтому энергия системы состоит из кинетической энергии частиц.
Статвес такой системы равен числу перестановок (переходов) частиц между
энергетическими ячейками системы
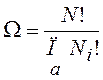 , (13.24)
, (13.24)
где а – число энергетических ячеек.
![]() (13.25)
(13.25)
Обозначив ![]() ,
запишем
,
запишем ![]() .
.
Энтропия системы
![]() , (13.26)
, (13.26)
где
Si=k×lnWi=kNi×ln(N/Ni) (13.27)
Вклад одной частицы в энтропию системы
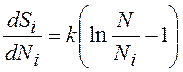 . (13.28)
. (13.28)
Поскольку N>>Ni, единицей можно пренебречь. Сравнивая (13.28) и (13.10), получаем
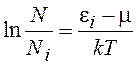 (13.29)
(13.29)
Потенцируя (13.29), получаем функцию Больцмана, характеризующую долю частиц, имеющих энергию ei (рис 13.1):
![]() (13.30)
(13.30)
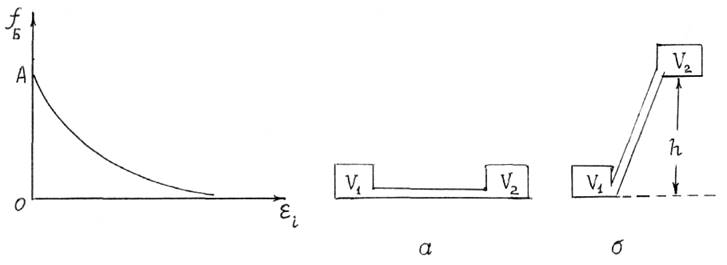
Рис. 13.1 Рис. 13.2
Рассмотрим примеры применения распределения Больцмана.
1. Пусть два сосуда с идеальным газом находятся в диффузионном контакте и располагаются на высоте h = 0. (рис.13.2,а). После того как один из сосудов подняли на высоту h, энергия каждого из атомов в нем возросла на mgh и начался диффузионный процесс перехода атомов из второго сосуда в первый. Когда химические потенциалы выравнялись m1=m2=m, система перешла в равновесное состояние. Обозначим N. число атомов в первом сосуде, средняя энергия каждого из которых e1; N2 – число атомов во втором сосуде, средняя энергия каждого из которых e2 = e1 + mgh. Запишем функции Больцмана
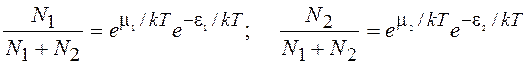 .
(13.31)
.
(13.31)
Отсюда
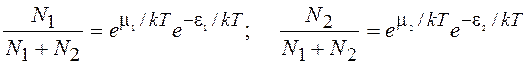 .
(13.32)
.
(13.32)
Пусть V1=V2=1 см3. Тогда концентрация атомов во втором сосуде
![]() (13.33)
(13.33)
где n1 – концентрация атомов в первом сосуде.
Из уравнения состояния идеального газа давление газа
![]() . (13.34)
. (13.34)
Умножив (13.32) на kT, получим барометрическую формулу
![]() . (13.35)
. (13.35)
2. Рассмотрим двухуровневую систему. Представим изолированную систему 2N молекул аммиака в равновесном состоянии. Допустим, что каждая молекула характеризуется только двумя дискретными значениями энергии E1 и E2 > E1 (см. § 15.3). Число молекул с энергией Е1 равно N1, а с энергией E2 равно N2.Статвес такой подсистемы
W=(2N)!/N1!×N2! (13.36)
Применяя формулу Стирлинга, получаем
![]() . (13.37)
. (13.37)
Введем новую переменную
х = N1 – N = N – N2. Преобразуем (13.37)
![]() (13.38)
(13.38)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.